
| A��������̼�볬�ٽ�ˮ�����������͵ķ�Ӧ�����ڷ��ȷ�Ӧ |
| B����ˮ�ȷ�Ӧ����һ�ָ��ӵ�������ѧ�仯 |
| C���������糧�������÷��ȣ���������̼ת��Ϊ��Դ���� |
| D�����ſƼ��Ľ�������ˮ�ȷ�Ӧ����ȡ��Դ����ʵ�ֵ�����̼��Դ�ĺ�гѭ�� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ˮ��ͨ��SO2 | B����ˮ������� |
| C����ˮ��Ͷ��һС������� | D����ˮ�м���NaCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1��9 | B��9��1 | C��1��11 | D��11��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
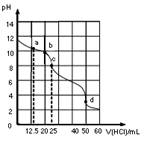
| A��a�㣺c��CO32-��=c(HCO3-)>c(OH-) |
| B��b�㣺5c(Cl-)>4c(HCO3-)+4c(CO32-) |
| C��c�㣺c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D��d�㣺c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ): n(
): n( )�仯�Ĺ�ϵ���±�:
)�仯�Ĺ�ϵ���±�:n( ): n( ): n( ) ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
 )�� c (
)�� c ( ) �� c (OH��) �� c(H+)
) �� c (OH��) �� c(H+)  ) �� c (
) �� c ( ) �� c (OH��) = c(H+)
) �� c (OH��) = c(H+)  )+c (
)+c ( )
)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaHCO3��Һ�У�c(H+) + c(Na+)��c(HCO3��)+2c(CO32��) + c(OH��) |
| B��pH=12��Ba(OH)2��Һ��pH=12��Na2CO3��Һ�У�ˮ�����c(H��)һ���� |
| C��0.2mol��L��1 HCl��Һ������0.05 mol��L��1 Ba(OH)2��Һ��Ϻ���Һ��pH��1 |
| D����10 mL 0.10mol?L��1CH3COOH��Һ��������ʵ�����NaOH����Һ�����ӵ�Ũ���ɴ�С��˳���ǣ�c(Na+)��c(CH3COO��)��c(OH������c(H+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
| �ζ����� | ����Һ��� (mL) | ��KMnO4��Һ���(mL) | |
| �ζ�ǰ���� | �ζ������ | ||
| ��һ�� | 25.00 | 0.50 | 20.40 |
| �ڶ��� | 25.00 | 3.00 | 23.00 |
| ������ | 25.00 | 4.00 | 24.10 |
| ������ | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| ��ɫ | �� | dz�� | �� | ש�� | �� |
| Ksp | 1.77��10��10 | 5.35��10��13 | 1.21��10��16 | 1.12��10��12 | 1.0��10��12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ǰ��С���߲��� | B��ǰ��С�������� | C�������� | D������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ������ | Na+��Ba2+��NH4+ | ������ | CO32����Cl����OH����SO42�� |
 = ��
= ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com