
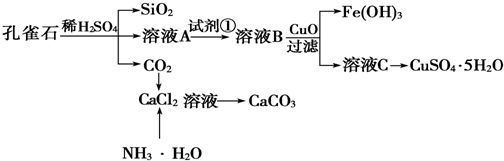
分析 孔雀石主要成分Cu2(OH)2CO3,其中还含少量Fe、Si的化合物.铁元素以+2、+3价存在,孔雀石与硫酸反应中,硫酸过量.由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,且不能引入新的杂质.
(1)由溶液B加入CuO可生成氢氧化铁沉淀可知,B应为含Fe3+的溶液,则试剂①应将Fe2+氧化为Fe3+;可用KSCN检验;
(2)由溶液制得晶体,应进行蒸发、冷却结晶、过滤等操作;过滤操作一般要用到三种玻璃仪器:烧杯、漏斗、玻璃棒.玻璃棒的作用是引流,避免液体外溅;
(3)根据流程图知,生成的气体F为二氧化碳,在氯化钙溶液中通入氨气、二氧化碳制备碳酸钙纳米材料.因为二氧化碳不与氯化钙溶液反应,同时二氧化碳在水中的溶解度很小,因此,要先向氯化钙溶液中加入氨水或通入氨气,在碱性溶液中通入二氧化碳,增加二氧化碳的溶解度,从而生成碳酸钙;
(4)酸性高锰酸钾具有强氧化性,可以腐蚀橡胶管,故应用酸式滴定管取KMnO4标准溶液,根据定容的方法来回答;
解答 解:孔雀石主要成分Cu2(OH)2CO3,其中还含少量Fe、Si的化合物.铁元素以+2、+3价存在,孔雀石与硫酸反应中,硫酸过量.由工艺流程转化关系可知,实现由溶液A至溶液B转化,目的是将Fe2+氧化为Fe3+,试剂①应为氧化剂,且不能引入新的杂质.试剂②应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,且不能引入新的杂质.
(1)由溶液B加入CuO可生成氢氧化铁沉淀可知,B应为含Fe3+的溶液,则试剂①应将Fe2+氧化为Fe3+,为不引入新的杂质,可用H2O2为氧化剂,可用KSCN检验Fe3+,
故答案为:c;d;
(2)由溶液制得晶体,应进行蒸发、冷却结晶、过滤等操作;过滤操作一般要用到三种玻璃仪器:烧杯、漏斗、玻璃棒.玻璃棒的作用是引流,避免液体外溅,
故答案为:蒸发、冷却结晶、过滤;引流;
(3)根据流程图知,生成的气体F为二氧化碳,在氯化钙溶液中通入氨气、二氧化碳制备碳酸钙纳米材料.因为二氧化碳不与氯化钙溶液反应,同时二氧化碳在水中的溶解度很小,因此,要先向氯化钙溶液中加入氨水或通入氨气,在碱性溶液中通入二氧化碳,增加二氧化碳的溶解度,从而生成碳酸钙,故答案为:NH3(NH3•H2O).
(4)酸性高锰酸钾溶液具有强氧化性,碱式滴定管下端有一段橡胶管,橡胶管能被酸性高锰酸钾氧化,故应选择酸式滴定管;定容时视线应平视凹液面(或平视刻度线),直到凹液面的最低点与刻度线相切,故答案为:平视凹液面(或平视刻度线);凹液面的最低点与刻度线相切;酸式.
点评 本题以化学工艺流程图为载体,设计方案制备重要化学试剂蓝矾和碳酸钙纳米材料,考查无机化学与实验的融合能力,以及完成基本实验操作的能力,难度大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能发生银镜反应 | B. | 在一定条件下可氧化成羧酸 | ||
| C. | 与氢气加成只能生成丙醛 | D. | 可使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解产物为Cl2和Na | |
| B. | 电解过程中能产生黄绿色气体 | |
| C. | 电解一段时间后,将全部电解液转移到烧杯中,然后滴加酚酞溶液,溶液呈红色 | |
| D. | 用排水集气法可以收集到较纯净的氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com