
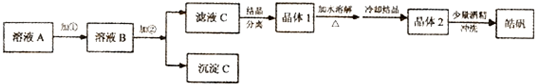
| ��ʼ���� | ������ȫ | |
| Fe��OH��3 | 2.7 | 3.7 |
| Fe��OH��2 | 7.6 | 9.6 |
| Zn��OH��2 | 5.7 | 8.0 |
���� �������֪��ҺA�����������ӡ�п���ӣ����ݿ�ʼ�����������������������ȫ��pH��Χ�ֱ�Ϊ��Fe��OH��3��2.7-3.7Fe��OH��2��7.6-9.6 Zn��OH��2��5.7-8��ֱ�ӳ����������ӣ�п����Ҳ��ȫ��ȫ������������ʵ��ʵ��Ŀ�ĺ�Ҫ��Ӧ��Ҫ�Ȱ�������������Ϊ�����ӣ�������ҺPHʹ����������ȫ����������ʱп���Ӳ���������������������������µ����ʣ�ͨ����20%��H2O2 Ȼ�����ZnO[ZnCO3��Zn��OH��2��]�Ե�����Һ��pH��3.7-5.7��ʹ��Fe3+��ȫת��ΪFe��OH��3������ͬʱ���������µ����ʣ����˺���Һ��������Ũ������ȴ�ᾧ�ɵõ�ZnSO4•7H2O��ϴ�Ӿ���ʱ��Ϊ���⾧���ܽ⣬���þƾ�����ϴ�ӣ��Դ˽����⣮
��� �⣺��l���������Ϸ�����֪�Լ���ӦΪ�������⣬�ɽ������Һ�е�Fe2+����ΪFe3+��ͬʱ���������µ����ʣ���Ӧ�����ӷ���ʽΪ2H++H2O2+2Fe2+=2Fe3++2H2O��
�ʴ�Ϊ��20%��H2O2��2H++H2O2+2Fe2+=2Fe3++2H2O��
���Լ�2������������ҺPH��3.7��Ŀ����������ȫ������������ʵ�鲻�������µ����ʣ�Zn�ۻ�������õ��������ӻ�ԭ������ȥ�����ã�ZnO��Zn��OH��2��ZnCO3���Է�Ӧ������ҺPH��3.7��ʹ�����ӳ�����ͬʱ�������µ����ʣ�ZnSO4���ܵ�����ҺPH��������������������ӣ�
�ʴ�Ϊ��ZnO��Zn��OH��2��������Һ��pH��3.7-5.7��ʹFe3+��ȫת��ΪFe��OH��3������ͬʱ���������µ����ʣ�
�۾����ܽ��ٽᾧ���ᴿ����ķ���Ϊ�ؽᾧ���ʴ�Ϊ���ؽᾧ��
����������ϡ�����ܽ⣬�ܽ�����м����ϡ������������Ʊ�����п������Zn2++2H2O?Zn��OH��2+2H+��ͬʱ����п���ӵ�ˮ�⣬
�ʴ�Ϊ��Zn2++2H2O?Zn��OH��2+2H+��ϡ���������ZnSO4��ˮ�⣬��ֹ����Zn��OH��2���ʣ�
�ݵӾ��������������ӣ�ͬʱ����𩷰�������ʧ���ڵõ�𩷯ʱ�������м��������ƾ�ϴ�Ӷ�����ˮ��ԭ���ǣ���������ˮ�������ھƾ�������Ŀ����Ϊ�˳�ϴ�����������������ӣ���ֹ�����ܽ⣬Ӱ����ʣ�
�ʴ�Ϊ��Ϊ�˳�ϴ����������������Һ����ֹ�����ܽ⣬Ӱ����ʣ�
��2�����е�������Ϊ�������ӻ������ӣ���֤ʱ����ȡ����𩷯����ˮ���Ƴ���Һ����������Һ�еμ�����KSCN��Һ��������������˵������Fe3+������Һ��Ϊ��ɫ��˵����Fe3+��
�ʴ�Ϊ��ȡ����𩷯����ˮ���Ƴ���Һ����������Һ�еμ�����KSCN��Һ��������������˵������Fe3+������Һ��Ϊ��ɫ��˵����Fe3+��
���� �����ۺϿ������ʵ��Ʊ������롢�ᴿ��֪ʶ��������ѧ���ķ���������ʵ�������Ŀ��飬Ϊ�߿��������ͣ�ע�����ʵ��IJ���ԭ���Ͳ��裬����������ʵ����ʣ��Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ǵ�ȼ������2800 kJ•mol-1����$\frac{1}{2}$C6H12O6��s��+3O2��g���T3CO2��g��+3H2O��l����H=-1400 kJ•mol-1 | |
| B�� | ��֪101 kPaʱ��2C��s��+O2��g���T2CO��g����H=-221 kJ•mol-1����÷�Ӧ�ķ�Ӧ��Ϊ221 kJ•mol-1 | |
| C�� | ��֪ϡ��Һ�У�H+��aq��+OH-��aq���TH2O��l����H=-57.3 kJ•mol-1����ϡ������ϡ����������Һ��Ӧ����1 molˮʱ�ų�57.3 kJ������ | |
| D�� | ��֪HCl��NaOH��Ӧ���к��ȡ�H=-57.3 kJ•mol-1����98%��Ũ������ϡ����������Һ��Ӧ����1 molˮ���к���Ϊ-57.3 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.1g | B�� | 3.6g | C�� | 7.2g | D�� | ��ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �õ���KI��ֽ������������NO2���� | |
| B�� | ֤��Fe2O3�Ǽ���������ɽ����������ϣ��۲����� | |
| C�� | ��NaOH��Һ����մ��Ƥ���ϣ�Ӧ�������ô�����������ϴ | |
| D�� | ��ȥMnO2�е�����KMnO4���ɽ���������ˮ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
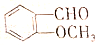 �ж���ͬ���칹�壮���к��б������ܷ���ˮ�ⷴӦ���У�������
�ж���ͬ���칹�壮���к��б������ܷ���ˮ�ⷴӦ���У�������| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
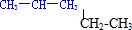 ��뭡�뮺��
��뭡�뮺���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
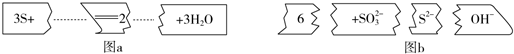
| A�� | ��ƽ��Ļ�ѧ����������Ϊ3��1��2��6��3 | |
| B�� | ����1 mol S��������������2 mol S2- | |
| C�� | �������뻹ԭ�������ʵ���֮��Ϊ1��2 | |
| D�� | 2 mol S�μӷ�Ӧ��3 mol���ӷ���ת�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com