
【题目】某烷烃 X分子中碳与氢的质量比为 36∶7。现取两支试管,分别加入适量溴水,实验操作及现象如下:

有关 X 的说法正确的是
A.相同条件下,X 的密度比水大
B.X的分子式为C6H14,X的同分异构体共有 6 种
C.X 能与 Br2发生加成反应使溴水褪色
D.试验后试管 2 中的有机层是上层还是下层,可通过加水确定
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
【题目】能表示H2(g)+ I2(g)![]() 2HI(g)已经达到平衡状态的标志是( )
2HI(g)已经达到平衡状态的标志是( )
①c(H2)=c(I2)=c(HI)时
②c(H2):c(I2):c(HI)=1:1:2时
③c(H2)、c(I2)、c(HI)不再随时间而改变
④单位时间内生成nmolH2的同时生成2nmolHI
⑤单位时间内生成nmolH2的同时生成nmolI2
⑥反应速v(H2)=v(I2)=1/2v(HI)
⑦一个H-H键断裂的同时有两个H-I键断裂
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
条件一定,混合气体的平均相对分子质量不再变化
A.③④⑦⑨⑩B.③④⑦⑨C.②③④⑦⑨D.②③④⑥⑦⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组利用下图装置制取少量氯化铝,已知氯化铝熔沸点都很低(178℃升华),且易水解。下列说法中完全正确的一组是
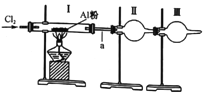
①氯气中含的水蒸气和氯化氢可通过盛有苛性钠的干燥管除去
②装置I中充满黄绿色气体后,再加热盛有A铝粉的硬质玻璃管
③装置II是收集装置,用于收集氯化铝
④装置III可盛放碱石灰也可盛放无水氯化钙,二者的作用相同
⑤a处使用较粗的导气管实验时更安全
A. ①② B. ②③⑤ C. ①④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学课上围绕浓硫酸的化学性质进行如下实验探究,将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。请回答下列问题:
(1)生成的这种黑色物质(单质)是(填化学式)________。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的污染物之一,这种刺激性气味气体为(填化学式)___,反应的化学方程式为________。
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填字母) _______。
A 酸性 B 吸水性 C 脱水性 D 强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,探究SO2与品红作用的可逆性,请写出实验操作及现象______。;将(2)中产生的有刺激性气味的气体通入氯水中,发生反应的化学方程式为_______。
(5)工厂煤燃烧产生的烟气若直接排放到空气中,引发的主要环境问题有_____。
A 温室效应 B 酸雨 C 粉尘污染 D 水体富营养化
工业上为实现燃煤脱硫,常通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,与烟气中SO2反应从而将硫固定,其产物可作建筑材料。写出其中将硫固定的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)为白色结晶粉末,易溶于水,在中性或碱性条件下稳定,在酸性条件下发生反应(S2O32-+2H+=S↓+SO2+H2O),是一种重要的化工原料。请回答下列问题:
(1)Na2S2O3溶液可用作照相底片(AgBr)中的定影剂,其原理是将未感光的AgBr转化为可溶于水的稳定络合物Na3[Ag(S2O3)2]。写出该络合反应的离子方程式___。
(2)工业上利用硫化碱残渣(主要成分Na2S,Na2CO3)与硫黄废气(主要成分SO2)反应,经吸硫、蒸发、结晶,制得硫代硫酸钠。巳知该反应中C(碳)原子化合价不变,则氧化剂和还原剂物质的量之比为___。
(3)Na2S2O3长期暴露在空气中易被氧化生成Na2SO4,设计实验方案检验Na2S2O3是否变质(已知BaS2O3微溶于水)___。
(4)现有含Na2S2O3·5H2O的样品,用以下方法计算Na2S2O3·5H2O的质量分数。
a.取样品7.0g溶于蒸馏水中,并定容至500mL容量瓶中待用。
b.取0.01mol.L-1的K2Cr2O7标准溶液20.00mL于锥形瓶中,加过量KI溶液并酸化,加2滴淀粉指示剂,用a中未知浓度的Na2S2O3待测液滴定至终点,共用去25.00mL。(已知2S2O32-+I2=S4O62-+2I-),在酸性环境中Cr2O72-被还原为绿色的Cr3+)。
回容下列问题:
①滴定终点的现象是___。
②样品中Na2S2O3·5H2O的质量分数为___(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2X(g)+Y(g)2Z(s) △H= -M kJ·mol-1。T℃,将2 mol X(g)和1 mol Y(g)加入体积为1L的恒容密闭容器中进行反应, 10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法不正确的是
A.其他条件不变,压缩容器,逆反应速率不变
B.在10 min内,X的反应速率为0.02 mol·L-1·min-l
C.在5 min末,X、Y的转化率不相等
D.在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。已知:16g液态肼与液态过氧化氢恰好完全反应生成氮气和液态水时放出321kJ热量,试写出液态N2H4和液态H2O2反应的热化学方程式__________。
(2)已知:N2H4(l)+O2(g)=N2(g)+2H2O(g)。肼(N2H4)—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是_______。
(3)将浓度均为0.10 mol·L-1的CH3COOH溶液和NaOH溶液等体积混合,所得混合溶液中各种离子浓度大小顺序_______________。
(4)已知某温度下,纯水中的c(H+)= 2.0×10-7 mol/L。该温度下,测定某硫酸溶液中c(SO42-)=5×10-6mol/L,该硫酸溶液中由水电离出的OH-浓度为_________________。
(5)在25 ℃时,向V mL pH=m的HNO3中滴加pH=n的KOH溶液10V mL时,溶液中n(NO3-)=10 n(K+),则m+n的值为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84g/cm3)配制0.5mol/L的稀硫酸480mL。
(1)选用的主要玻璃仪器除量筒和玻璃棒外还需要有:
①___②___③___。
(2)简要回答下列问题
①所需浓硫酸的体积为___mL;
②如果实验室有10mL、20mL、50mL的量筒应选用___mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取,将使浓度___(填“偏高”、“偏低”或“无影响”,下同)。
③在转入容量瓶前,烧杯中液体应___,否则会使浓度___。
④定容时必须使溶液凹液面与刻度线相平,若俯视会使浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,B苯环上的一硝基取代物有三种,有关物质之间的转化关系如下:
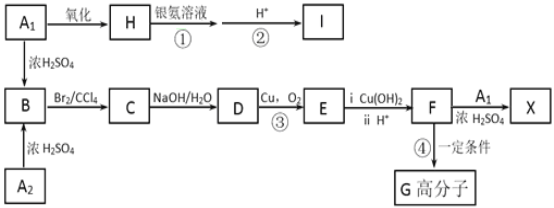
⑴D的分子式为_________________,I中官能团结构简式为_______________________,反应④的反应类型为________________。
⑵写出下列物质的结构简式:A2___________________;X __________________。
⑶写出下列反应的化学方程式:①_______________________________。
⑷化合物J是比化合物E多一个碳原子的E的同系物,化合物J有多种同分异构体,其中同时满足下列条件的同分异构体有___________________种;
①苯环上有两个取代基; ②能使FeCl3溶液显色; ③与E含有相同官能团
写出其中核磁共振氢谱图中峰面积比为1:1:2:2:6的结构简式:_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com