
| A. | CH3COOH | B. | CH3COOCH2CH3 | C. | CH2=CHCOOH | D. | 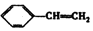 |
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ③⑥ | C. | ①② | D. | ⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离对硝基甲苯和邻硝基甲苯:蒸馏 | |
| B. | 除去甲基丙烯酸甲酯中少量甲醇:蒸馏 | |
| C. | 除去漠苯中少量水:分液 | |
| D. | 从粗产品中提纯苯甲酸钠:重结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2在反应中只作氧化剂 | |
| B. | 由于Na2O2与H2O反应放出热量和氧气,所以脱脂棉剧烈燃烧 | |
| C. | Na2O2与H2O反应中有氢氧化钠生成,Na2O2是典型的碱性氧化性 | |
| D. | Na2O2与H2O反应中有氧气生成,可用于防毒面具上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Fe3+、SO42- | B. | Na+、[Al(OH)4]-、CO32- | ||
| C. | Na+、[Al(OH)4]-、SO42-、CO32- | D. | Na+、Ba2+、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
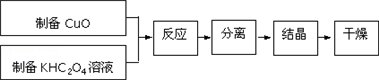
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com