
 ,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.
,Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为1:1.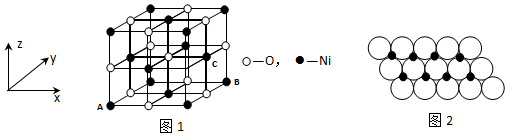
分析 (1)基态 Cl原子电子排布为1s22s22p63s23p7,此时其核外电子占有的原子轨道数为9,同周期随原子序数增大,元素第一电离能呈增大强酸,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:Cl>P>S;
(2)SCl2中S原子杂化轨道数为$\frac{1}{2}$(6+2)=4,采取 sp3杂化方式,该分子构型为V形;
(3)PH4Cl的电子式为 ,Ni与CO能形成配合物Ni(CO)4,该分子中σ键为:1×4+4=8与π键个数为:2×4=8;
,Ni与CO能形成配合物Ni(CO)4,该分子中σ键为:1×4+4=8与π键个数为:2×4=8;
(4)离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(5)NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),而C离子的x系坐标与Bx系坐标相同,y、z系坐标都在中点上,所以C离子坐标参数为(1,1/2,1/2);
(6)根据图片知,每个氧化镍所占的面积=(2×am)×(2×a×m×sin60°),每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,每个氧化镍的质量乘以每平方米含有的氧化镍个数就是每平方米含有的氧化镍质量.
解答 解:(1)基态 Cl原子电子排布为1s22s22p63s23p7,此时其核外电子占有的原子轨道数为9,同周期随原子序数增大,元素第一电离能呈增大强酸,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:Cl>P>S,
故答案为:9;Cl>P>S;
(2)SCl2中S原子杂化轨道数为$\frac{1}{2}$(6+2)=4,采取 sp3杂化方式,两对孤对电子对,所以该分子构型为V形,故答案为:sp3;V形;
(3)PH4Cl的电子式为 ,Ni与CO能形成配合物Ni(CO)4,该分子中σ键为:1×4+4=8与π键个数为:2×4=8,所以个数之比为1:1,
,Ni与CO能形成配合物Ni(CO)4,该分子中σ键为:1×4+4=8与π键个数为:2×4=8,所以个数之比为1:1,
故答案为: ;1:1;
;1:1;
(4)Mg2+半径比Ni2+小,所以氧化镁的晶格能大于氧化镍,则熔点:MgO>NiO,故答案为:>;Mg2+半径比Ni2+小,MgO的晶格能比NiO大;
(5)NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),而C离子的x系坐标与Bx系坐标相同,y、z系坐标都在中点上,所以C离子坐标参数为(1,1/2,1/2),故答案为:(1,1/2,1/2);
(6)(5)根据图片知,每个氧化镍所占的面积=(2×am)×(2×am×sin60°)=2$\sqrt{3}$a2m2,则每平方米含有的氧化镍个数=$\frac{1}{2\sqrt{3}{a}^{2}}$,每个氧化镍的质量=$\frac{74.7}{{N}_{A}}$g,所以每平方米含有的氧化镍质量=$\frac{74.7}{{N}_{A}}$×$\frac{1}{2\sqrt{3}{a}^{2}}$g=$\frac{25\sqrt{3}}{2{a}^{2}{N}_{A}}$,故答案为:$\frac{25\sqrt{3}}{2{a}^{2}{N}_{A}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、空间结构、化学键、杂化轨道、晶体结构与计算等,(5)中注意计算“1NiO”的体积应包含孔隙体积,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 化学反应中一定伴随能量变化 | |
| B. | 甲烷燃烧是将全部的化学能转化为热能 | |
| C. | 物质所含化学键键能越大,其越稳定 | |
| D. | 大量燃烧煤炭等化石燃料是造成雾霾天气的重要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式: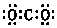 | B. | 中子数为21的钾原子:${\;}_{19}^{40}$K | ||
| C. | 甲烷分子的球棍模型: | D. | 氯离子的结构示意图: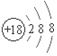 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27.6% | B. | 30% | C. | 47% | D. | 78% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的简单气态氢化物的热稳定性比Y的强 | |
| B. | W的氧化物的水化物的酸性一定比X的强 | |
| C. | 半径r(W)>r(Z)>r(Y)>r(X) | |
| D. | Z与Y形成的两种常见化合物中,阴、阳离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 |
| A | 将浸透了石蜡油的石棉放在大试管底部.试管中加人碎 瓷片,给碎瓷片加强热,产生的气体持续通入溴的四氯化碳溶液 | 红棕色逐渐变浅,最终褪去 |
| B | 将乙烯在空气中点燃 | 火焰呈蓝色并伴有黑烟 |
| C | 向盛有苯的试管中加入几滴酸性KMnO溶液,充分振荡 | 液体分层,溶液紫色褪去 |
| D | 将蔗糖溶液与稀硫酸混合水浴加热,取反应后的溶液少量.加人几滴新制的Cu(OH)2悬浊液加热 | 出现砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它与乙烯一定是同系物 | |
| B. | 它一定能使溴水褪色 | |
| C. | 它的一氯代物可能只有一种 | |
| D. | 等质量CH4和C4H8分别在氧气中完全燃烧,CH4的耗氧量小于C4H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com