
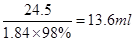 ;量取13.6ml浓硫酸,所需要量筒的规格应该大于13.6mol,且和13.6ml越接近,误差越小,所以选择20ml的量筒;配制一定物质的量浓度溶液的实验中需要的仪器是烧杯、玻璃棒、胶头滴管、500 mL容量瓶;根据c=n/V可知,①未冷却至室温即转移至容量瓶,则冷却后容量瓶中溶液的体积偏小,浓度偏高;②定容时仰视刻度线,则容量瓶中溶液的体积偏多,浓度偏小;③如果洗涤量筒并将洗涤液注入容量瓶中,则溶质的物质的量偏多,浓度偏高。
;量取13.6ml浓硫酸,所需要量筒的规格应该大于13.6mol,且和13.6ml越接近,误差越小,所以选择20ml的量筒;配制一定物质的量浓度溶液的实验中需要的仪器是烧杯、玻璃棒、胶头滴管、500 mL容量瓶;根据c=n/V可知,①未冷却至室温即转移至容量瓶,则冷却后容量瓶中溶液的体积偏小,浓度偏高;②定容时仰视刻度线,则容量瓶中溶液的体积偏多,浓度偏小;③如果洗涤量筒并将洗涤液注入容量瓶中,则溶质的物质的量偏多,浓度偏高。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源:不详 题型:计算题
 ? SO
? SO 的物质的量浓度是 ?
的物质的量浓度是 ?查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/L | B.0.2mol/L | C.0.4mol/L | D.0.8mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.2 mol·L-1 | B.0.3 mol·L-1 | C.2 mol·L-1 | D.3 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| | a | b | c | d | e |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 无关的组合是
无关的组合是 ②摩尔质量(M) ③原子半径(r) ④物质的量(n) ⑤气体摩尔体积(V
②摩尔质量(M) ③原子半径(r) ④物质的量(n) ⑤气体摩尔体积(V
| A.①③⑥⑦ | B.②④⑤⑥ | C.①②③⑤ | D.②③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
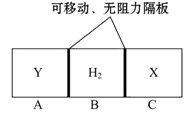
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8∶3 | B.3∶2 | C.1∶3 | D.2∶3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com