

分析 (1)一氧化碳具有还原性可以还原氧化铁生成铁和二氧化碳;
(2)中性或弱酸性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应;
(3)铁锈和HCl反应生成铁离子,铁离子和Fe发生氧化还原反应生成亚铁离子;
(4)一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,据此分析解答;
(5)①在铁件的表面镀铜时,金属铜必须是阳极材料,金属铁为阴极,根据电解池的工作原理来回答;
②电镀池中,作阳极的是镀层金属,做阴极的是待镀金属,金属阳离子在该极上发生得电子的还原反应,在原电池中,负极金属更易被腐蚀;
③金属为原电池负极时,易发生电化学腐蚀.
解答 解:(1)一氧化碳可以还原氧化铁生成铁和二氧化碳,化学方程为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe;
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe;
(2)钢铁在潮湿的空气中发生吸氧腐蚀,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
(3)铁锈和HCl反应生成铁离子,铁离子和Fe发生氧化还原反应生成亚铁离子,离子方程式为2 Fe3++Fe═3 Fe2+,故答案为:2Fe3++Fe═3 Fe2+;
(4)同一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,所以铁棒被腐蚀由难到易的顺序是D、B、C、A,
故答案为:D、B、C、A;
(5)①在铁件的表面镀铜,金属铜必须是阳极材料,金属铁为阴极,则B为铁,A为Cu失电子生成铜离子,其发生的电极反应:Cu-2e-=Cu2+,
故答案为:铁;Cu-2e-=Cu2+;
②电镀时两极反应为:A电极:Cu-2e-=Cu2+,B电极上:Cu2++2e-=Cu,若电镀时电路中通过的电子为0.2mol,则A极上质量减少6.4g,B极上质量增加6.4g,所以A、B两极质量相差12.8g,
故答案为:12.8;
③铁比铜活泼,形成原电池反应时,铁为负极,铜为正极,镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,而锌比铁活泼,形成原电池反应时,铁为正极,锌为负极,铁难以被氧化,
故答案为:镀层破损后,镀铜铁形成的原电池中铁作负极被腐蚀,镀锌铁形成的原电池中铁为正极被保护.
点评 本题考查了金属的冶炼、原电池、电解池知识,设计方程式书写,电极反应式书写,有关电化学计算,金属的腐蚀与防护,题目综合性较强,难度中等,注意把握原电池的工作原理以及金属的防护方法.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | >100 mL | B. | =100 mL | C. | <100 mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 工业设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到了宝贵的能源物质.为了探究反应原理,先进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
工业设计用CO2来生产燃料甲醇,既减少二氧化碳气体,又得到了宝贵的能源物质.为了探究反应原理,先进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,在某温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
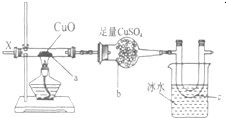 按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )
按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )| A. | ①③ | B. | ① | C. | ③④ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙酸分子中含有羧基,乙酸的酸性比碳酸弱 | |
| C. | 乙醇、乙酸都能发生酯化反应 | |
| D. | 只用水就能鉴别苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强一定能加快化学反应速率 | |
| B. | 使用催化剂,使反应的活化能降低,反应速率加快,平衡右移 | |
| C. | 减小反应物浓度可以减小化学反应速率常数,从而减小化学反应速率 | |
| D. | 升高温度,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 质量比为2:1的SO2和O2 | |
| B. | 9g水和23g乙醇(C2H5OH) | |
| C. | 标况下44.8L的NO和100ml 5mol/L的硫酸溶液 | |
| D. | 物质的量相同的H2SO3和FeSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com