
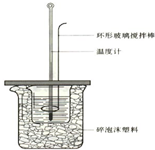
 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在如图装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:分析 (1)环形铜棒是热的良导体,会使热量损失;
(2)中和热测定实验成败的关键是保温工作;
(3)不盖硬纸板,会有一部分热量散失;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
解答 解:(1)中和热测定实验成败的关键是保温工作,因为环形铜棒是热的良导体,其导热效果好于环形玻璃搅拌棒;
故答案为:不能;因金属易导热;
(2)大小烧杯之间填满碎泡沫塑料的作用是减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,与上述实验相比,生成水的物质的量增多,所放出的热量增加,但是中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关;
故答案为:增加;不变.
点评 本题考查学生中和热测定,保温工作是实验成功的关键,掌握实验原理即可解答,难度不大.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 充电时铁做负极,NiO2做正极 | |
| B. | 放电时阴极上的电极反应为:Fe(OH)2+2e-=Fe+2OH- | |
| C. | 放电时,电解质溶液中的阴离子是向正极方向移动 | |
| D. | 蓄电池的两个电极必须浸入在碱性溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制NaOH溶液是,把NaOH固体放在天平左边托盘的滤纸上称量 | |
| B. | 配制稀硫酸时可先在量筒中加入一定体积的水,边搅拌边慢慢加入浓硫酸 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 用稀盐酸洗净做焰色反应的铁丝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100mL量筒量取23.25mL浓硫酸溶液 | |
| B. | 用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| D. | 用已知浓度的酸性高锰酸钾溶液滴定未知浓度草酸的实验中不用加指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为强酸、乙为弱酸,则c(甲):c(乙)=10:1 | |
| B. | 若甲为弱酸,乙为强酸,则一定满足c(甲)>c(乙) | |
| C. | 若甲为强酸,乙为弱酸,则其物质的量浓度不可能相等 | |
| D. | 若甲、乙均为弱酸,则甲酸的电离常数一定比乙酸大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com