
(15分)
(1)某肉制品包装上印有相关配料:精选瘦肉、食盐、胭脂红、苯甲酸钠。其中属于调味剂的是 ,属于着色剂的是 ,属于防腐剂的是 。
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
| 2a+32b |
| a+b |
| 2a+32b |
| a+b |
| 32(a+b) |
| 16a+b |
| 32(a+b) |
| 16a+b |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
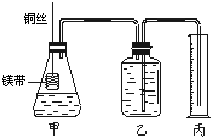 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为查看答案和解析>>
科目:高中化学 来源:2012届高三上学期化学一轮复习《化学家眼中的物质世界》专题综合测试(苏教版) 题型:计算题
(8分)(1)标准状况下,1.92g某气体的体积为672mL,则此气体的相对分子质量为________。
(2)在25℃、101kPa的条件下,同质量的CH4和A气体的体积之比是15 ∶8,则A的摩尔质量为________。
(3)两个相同容积的密闭容器X、Y,在25℃下,X中充入ag A气体,Y中充入ag CH4气体,X与Y内的压强之比是4 ∶11,则A的摩尔质量为________。
(4)相同条件下,体积比为a ∶b和质量比为a ∶b的H2和O2的混合气体,其平均相对分子质量分别是________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省石家庄市高三第二次模拟理科综合化学试卷(解析版) 题型:填空题
[化学一选修3:物质结构与性质](15分)
一水硫酸四氨合铜(II)(化学式为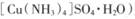 是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
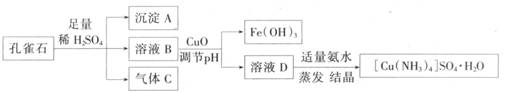
请回答:
(1) 沉淀A的晶体中最小环上的原子个数为______,气体C分子中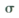 键和
键和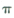 键的个数比为______
键的个数比为______
(2) 溶液D的溶质阴离子的空间构型为______,其中心原子的杂化轨道类型为______
(3) MgO的熔点高于CuO的原因为____________
(4) 画出一水硫酸四氨合铜(II)中配离子 的配位键____________。
的配位键____________。
(5)湿法炼铜就是利用溶液D制得铜单质,铜单质晶体中原子的堆积方式如图甲所示, 其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示。
①铜单质晶体中原子的堆积方式为____________,晶胞中Cu原子的配位数为______
②若Cu原子半径为acm,则Cu单质晶体的密度为______g/cm3(只列出计算式,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三第一次模拟试题理综化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】(15分)
卤代烃在醚类溶剂中与Mg反应可制得格氏试剂,格氏试剂在有机合成方面用途广泛。设R为烃基,已知:

某有机物A有如下转化关系: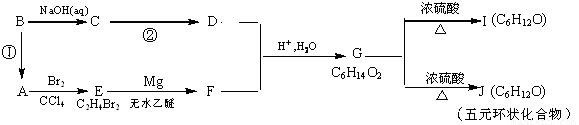
试回答下列问题:
(1) 反应①的反应试剂和实验条件是
(2) C→D的化学反应方程式为 ; 反应类型是 ;
(3) G的结构简式是___ ,G的最简单的同系物的名称是
(4)I中所含官能团的名称是
(5)分子式与I、J相同,但能发生银镜反应的异构体有 种。写出其中含—CH3个数最多的异构体的结构简式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com