
| A. | 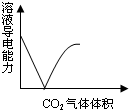 CO2通入澄清石灰水 | B. | 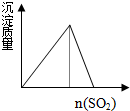 水玻璃中通入SO2 | ||
| C. | 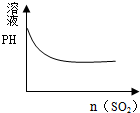 氯水中通入SO2 | D. | 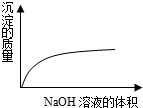 NaOH溶液滴入Ba(HCO3)2溶液 |
分析 A.CO2通入澄清石灰水:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,根据离子浓度变化判断导电能力;
B.亚硫酸的酸性强于硅酸,水玻璃中通入足量SO2,Na2SiO3+SO2+H2O═Na2SO3+H2SiO3↓,能制取硅酸;
C.氯水中通入SO2:Cl2+SO2+2H2O═4H++SO42-+2Cl-,生成了强酸,所以pH值变小;
D.NaOH溶液滴入Ba(HCO3)2溶液:Ba2++2HCO3-+2OH-═2H2O+BaCO3↓+CO32-,逐渐产生沉淀,且沉淀不溶解.
解答 解:A.CO2通入澄清石灰水:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,当完全沉淀时溶液中的离子浓度几乎为0,故导电能力也最低;再通CO2沉淀溶解生成了Ca(HCO3)2溶液,离子浓度又变大,故导电能力又加强,故A正确;
B.亚硫酸的酸性强于硅酸,水玻璃中通入足量SO2,Na2SiO3+SO2+H2O═Na2SO3+H2SiO3↓,能制取硅酸,逐渐产生沉淀,且沉淀不溶解,故B错误;
C.氯水中通入SO2:Cl2+SO2+2H2O═4H++SO42-+2Cl-,生成了强酸,所以pH值变小,当完全反应时pH值也几乎不变,故C正确;
D.NaOH溶液滴入Ba(HCO3)2溶液:Ba2++2HCO3-+2OH-═2H2O+BaCO3↓+CO32-,逐渐产生沉淀,且沉淀不溶解,故D正确.
故选B.
点评 本题考查加入试剂或通入气体的体积与产生沉淀的物质的量、导电能力、pH值的关系,先写出有关的反应式,然后根据反应物的物质的量之间的关系确定图象.


科目:高中化学 来源: 题型:选择题
 把一块镁铝合金投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是( )
把一块镁铝合金投入到50mL1mol/L的HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中正确的是( )| A. | 根据图象判断,镁铝合金与50mL1mol/L的HCl溶液恰好完全反应 | |
| B. | c值越大,合金中Mg的含量越高 | |
| C. | b值越大,合金中Al的含量越高 | |
| D. | 假设a=25,整个反应过程中,主要发生了6个离子反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/LNa2CO3溶液中有2NA个Na+ | |
| B. | 1L0.1mol/LCuSO4溶液中Cu2+有0.1NA个 | |
| C. | 常温下在PH=1或PH=13的溶液中均不可能有大量的HCO3- | |
| D. | 0.1mol/LCH3COONa溶液的PH=10,则说明CH3COONa是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{39.2}$<m<$\frac{1}{28}$ | B. | $\frac{1}{39.2}$<m<33.6 | C. | 0<m<$\frac{1}{22.4}$ | D. | $\frac{1}{28}$<$\frac{1}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将废弃的塑料袋回收进行露天焚烧,以解决“白色污染”问题 | |
| B. | 煤的干馏和石油的分馏均属于化学变化 | |
| C. | 用浸泡过的高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 | |
| D. | 福尔马林用于保存海鲜产品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com