
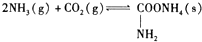
分析 (1)对比氨基甲酸铵的结构简式与尿素的结构简式可写出反应方程式;
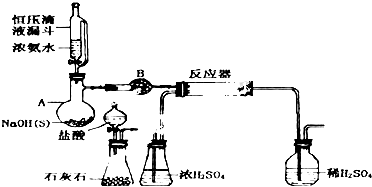
(2)依据图形和作用分析仪器B为干燥管(球形干燥管),由连接的A制备氨气可知,干燥管B中盛装的是碱石灰;
(3)反应在一定条件下能自发进行,则△G=△H-T△S<0,由于△S<0,所以△H必须小于0;
(4)使用干冰代替CO2发生装置的优点有很多,如省去了复杂仪器的连接,使得装置较为简单,易于操作;由(3)可知合成氨基甲酸铵的反应为放热反应,故干冰创造的低温环境有利于氨基甲酸铵的生成;不用对干冰进行干燥处理;
(5)导管过细有可能导致堵塞现象发生;用盐酸制备的二氧化碳气体中混有的HCl消耗氨气;稀硫酸、水蒸气进入反应器使产品不纯等.
解答 解:(1)对比氨基甲酸铵的结构简式与尿素的结构简式,依据原子守恒得到氨基甲酸铵在密封管内加热至120℃-140℃生成尿素的反应方程式为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O,
故答案为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O;
(2)仪器B为干燥管(球形干燥管),由连接的A制备氨气可知,干燥管B中盛装的是碱石灰,用来干燥氨气,
故答案为:干燥管;碱石灰;
(3)反应在一定条件下能自发进行,则△G=△H-T△S<0,由于△S<0,所以△H必须小于0,△H<0,
故答案为:<;
(4)干冰代替CO2发生装置的优点有很多,如省去了复杂仪器的连接,使得装置较为简单,易于操作,无需干燥,装置简单;由(3)可知合成氨基甲酸铵的反应为放热反应,故干冰创造的低温环境有利于氨基甲酸铵的生成,不用对干冰进行干燥处理,低温环境提高产率,
故答案为:无需干燥,装置简单;低温环境提高产率;
(5)从实验装置可以看出导管过细,有可能导致堵塞现象发生;用盐酸制备的二氧化碳气体中混有的HCl消耗氨气;稀硫酸、水蒸气进入反应器使产品不纯等,
故答案为:①反应器连接导管过细易造成堵塞;
②稀H2SO4水蒸气可进入反应器使产品不纯;
③CO2发生器中挥发的HCl未经处理进入反应器,会导致实验失败.
点评 本题考查了实验过程分析和评价,实验设计方法的理解应用,掌握实验基本操作和基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 某地燃烧化石燃料排放的废气中含CO2、SO2,使雨水pH=6形成酸雨 | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应 | |
| D. | 人造纤维,合成纤维和光导纤维都是有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| Fe3+ | Cu2+ | Fe2+ | |
| 开始沉淀的pH | 2.7 | 4.4 | 7.0 |
| 沉淀完全的pH | 3.7 | 6.4 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
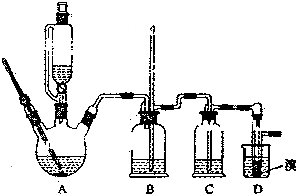 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/°C | 78.5 | 132 | 34.6 |
| 熔点/°C | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若不改变其它条件而换用一种更高效的催化剂,则反应达限度的时间会增长 | |
| B. | 达平衡后向容器中只充入O2不能提高反应速率 | |
| C. | 达到平衡时,SO2的转化率是80% | |
| D. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为114.90g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是2mol/L | B. | 都是3mol/L | ||
| C. | 1.5mol/L和3mol/L | D. | 分别是1mol/L和4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com