
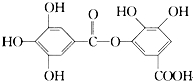
| A. | 它有酸性,1 mol该物质最多能与6 mol H2发生加成反应 | |
| B. | 在一定条件下,1 mol该物质最多能和4 mol Br2反应 | |
| C. | 它可以水解,水解产物为两种有机物 | |
| D. | 该有机物能发生取代反应 |
分析 由结构可知,分子中含酚-OH、-COOC、-COOH,结合酚、酯、羧酸的性质来解答.
解答 解:A.酚-OH、-COOH具有酸性,只有苯环与氢气发生加成反应,则1 mol该物质最多能与6 mol H2发生加成反应,故A正确;
B.酚-OH的邻、对位与溴水发生取代反应,则在一定条件下,1 mol该物质最多能和4 mol Br2反应,故B正确;
C.含-COOC-,可发生水解反应,且水解产物只有一种(苯环上3个-OH相连,-COOH与中间的-OH相对),故C错误;
D.含-OH、-COOH、-COOC-均可发生取代反应,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、羧酸、酯等有机物的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
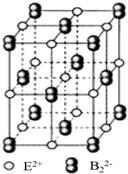 原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.
原子序数小于36的A、B、C、D、E五种元素,原子序数依次增大,A、D能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1,B是形成化合物种类最多的元素,C原子基态时2p原子轨道上有3个未成对的电子,E基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同.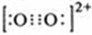 ;1mol D22+中含有的π键数目为2NA.
;1mol D22+中含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
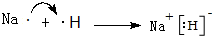 .
.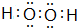
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
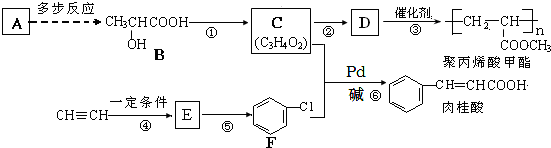
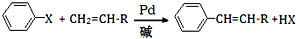 (X为卤原子,R为取代基)
(X为卤原子,R为取代基) ;反式肉桂酸的结构简式为
;反式肉桂酸的结构简式为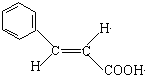 .
.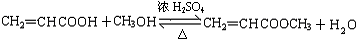 ;
;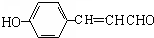 (写结构简式).
(写结构简式).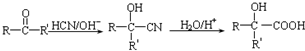 ,设设计由A(C2H4)制备B的合成路线(无机试剂任选):
,设设计由A(C2H4)制备B的合成路线(无机试剂任选):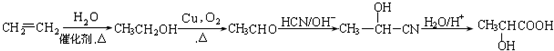 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝在生产、生活中得到广泛的应用,主要是因为其可用热还原法冶炼 | |
| B. | 对“地沟油”蒸馏可以获得汽油 | |
| C. | 氯气常用于自来水的消毒,是利用了氯气的强氧化性来杀菌消毒 | |
| D. | 化石燃料使用过程中排放的硫、氮的氧化物是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
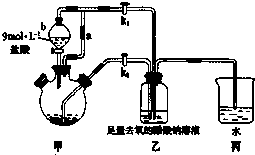 醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).
醋酸亚铬水合物[Cr(CH3COO)2]2•2H2O(相对分子质量为376)是一种为红棕色晶体,极易被氧气氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| B. | Fe(OH)3胶体为无色、透明,能发生丁达尔现象 | |
| C. | 在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解 | |
| D. | SiO2既能和氢氟酸反应又能和氢氧化钠溶液反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 催化剂组成 | 1 | 2 | 3 |
| WO3 W α-Fe2O3 | 65% 5% 30% | 65% 10% 25% | a b 20% |
| 六价铬去除率 | 60.2% | 80% | 72.9% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com