
分析 (1)由于题中强调足量的草酸,故反应后草酸转化为HC2O4-,若写成C2O42-是错误的.
(2)中显然说明草酸具有还原性,把MnO4-还原为Mn2+,根据氧化还原反应得失电子守恒配平反应方程式;
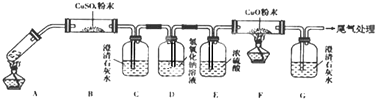
(3)检验二氧化碳可以用石灰水,除去二氧化碳可以用氢氧化钠溶液;乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成.
(4)两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度,结合守恒关系可得离子浓度间的大小关系.
解答 解:(1)题中强调足量的草酸,故反应后草酸转化为HC2O4-,且酸性强于碳酸,反应的离子方程式为HCO3-+H2C2O4=HC2O4-+CO2↑+H2O,
故答案为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;
(2)①向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明具有氧化性的高锰酸钾被还原,说明草酸具有还原性,把MnO4-还原为Mn2+,②反应中根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:还原性;2;5;6;2;10;8;
(3)检验二氧化碳可以用C装置中的澄清石灰水,除去二氧化碳可以用D中的氢氧化钠溶液,应将D装置改为长管进气短管出气;根据题意知乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除尽CO2,防止影响后续实验现象的判断,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成,
故答案为:应将D装置改为长管进气短管出气;除去混合气体中的CO2;H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑;
(4)该小组同学将2.52g草酸晶体(H2C2O4•2H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,两者正好1:1反应生成NaHC2O4;
A.电荷不守恒,正确的应为:c(Na+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-),故A错误;
B.物料不守恒,正确的应为:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.2mol•L-1,故B错误;
C.溶液显酸性说明HC2O4-的电离程度大于其水解程度(程度都较小),则有c(HC2O4-)>c(C2O42-)>c(H2C2O4)故C正确;
D.根据物料守恒可知c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故D正确;
故答案为:CD.
点评 本题考查已二酸的分解以及溶液离子浓度的大小比较,题目较为综合且具有一定难度,做题时注意抓住反应的现象,以此推断物质可能具有的性质,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 向AlCl3溶液中滴加过量NaOH溶液 | 溶液澄清 | Al3+与NaOH能大量共存 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 取少量溶液依次加入BaCI2溶液和稀盐酸产生白色沉淀,则原溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的单质不能通过氧化含该元素的化合物制得 | |
| B. | 得电子越多的氧化剂,其氧化性就越强 | |
| C. | 阳离子只能得到电子被还原,只能作氧化剂 | |
| D. | 含有最高价元素的化合物不一定具有强的氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com