
下列有关实验的叙述正确的是
A. 实验室中用生石灰与浓氨水混合的方法不能制得氨气
B. 中和滴定实验中,所用滴定管和锥形瓶均不能用待装液润洗
C. 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的1/3
D. 将KI和FeCl3溶液混合后,加入CCl4振荡静置,下层液体变紫色,说明氧化性:Fe3+> I2
科目:高中化学 来源:2017届江西省、宜春一中高三7月联考化学试卷(解析版) 题型:选择题
常温下,下列各组微粒在指定的溶液中一定能大量共存的是( )。
A.加入金属镁产生H2的溶液中:NH4+、Na+、SO42-、CH3COO-
B.含有大量ClO-的溶液中:K+、Na+、NO3-、SO42-
C.c(Cu2+)=0.1 mol·L-1的溶液中:H+、NH4+、Br-、CO32-
D.含有大量MnO4_的溶液中:H+、SO42-、Cl-、CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三7月暑期阶段性测试化学试卷(解析版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三入学考试理综化学试卷(解析版) 题型:选择题
一种三室微生物燃料电池污水净化系统原理如右图所示,图中有机废水中有机物可用C6H10O5表示。有关说法错误的是
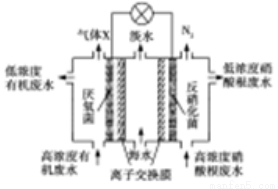
A.中间室Cl-移向左室
B.反应后将左右两室溶液混合比反应前将两室溶液混合的酸性强
C.气体X为CO2
D.左边离子交换膜为氯离子交换膜,右边离子交换膜为钠离子交换膜
查看答案和解析>>
科目:高中化学 来源:2017届湖南衡阳八中高三实验班暑期第一次月考理综化学(解析版) 题型:实验题
(本题满分18分)钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
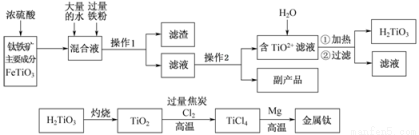
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解.
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 ,操作2是 、过滤,副产品主要成分的化学式为 。
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理 。
(3)已知钛的还原性介于铝和锌之间,估计钛能耐腐蚀的原因之一是 ,如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是 。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式为 。
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10mL用水稀释至100mL,加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+═3Ti3++AlO3++3H2O,过过滤后,取出滤液20.00mL,向其中滴加2~3滴KSCN溶液作指示剂,用 (填一种玻璃仪器的名称)滴加0.1000mol•L﹣1FeCl3溶液,发生Ti3++Fe3+═Ti4++Fe2+,当溶液出现红色达到滴定终点,用去了30.00mLFeCl3溶液,待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:实验题
现有一份含有FeCl3和FeCl2固体的混合物,为测定FeCl2的含量,进行如下实验:
①称取混合物样品的质量7.06g,将样品溶解
②向溶解后的溶液中,加入足量的双氧水
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4.00g
根据实验回答下列问题:
(1)样品溶解过程中需加入 ,以防止 ;
(2)写出溶解后的溶液与双氧水反应的离子方程式 ;
(3)过滤操作中除用漏斗外,还需要的玻璃仪器有 ;
(4)简述检验实验步骤④中沉淀已经洗涤干净的方法 ;
(5)通过实验所得数据,计算固体样品中FeCl2的质量分数: ;
(6)实验室采用如图装置制取少量无水FeCl3固体.(已知FeCl3固体易潮解,部分夹持仪器已略去.)

该装置存在明显缺陷,得不到无水FeCl3固体,请你对该装置进行合理的改进: .
查看答案和解析>>
科目:高中化学 来源:2017届河北沧州市高三上学期第一次月考化学试卷(解析版) 题型:实验题
(16分)如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约为1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
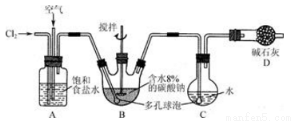
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)① 实验中控制氯气与空气的体积比的方法是 。
② 为使反应充分进行实验中采取的措施有 。
(2)① 装置B中产生Cl2O的化学方程式为 。
② 若B无冷却装置,进入C中的Cl2O会大量减少。其原因是 。
(3)装置C中采用棕色圆底烧瓶是因为 。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中所得次氯酸溶液的物质的量浓度的实验方案为:用 量取20.00 mL次氯酸溶液, 。
(可选用的试剂有H2O2溶液、FeCl2溶液、AgNO3溶液。)
查看答案和解析>>
科目:高中化学 来源:2017届湖南长沙一中高二上第一次月考(开学考试)化学卷(解析版) 题型:选择题
0.5mol某羧酸与足量乙醇发生酯化反应,生成酯的质量比原羧酸的质量增加了28g,则原羧酸可能是
A.甲酸 B.乙二酸 C.丙酸 D.丁酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com