
| ||


科目:高中化学 来源: 题型:阅读理解
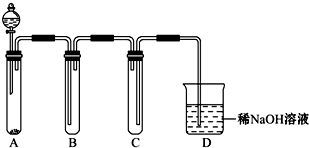 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.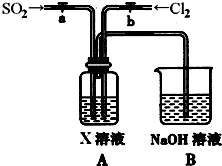
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| 微热 |
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市红桥区高三第一次模拟考试理综化学试卷(解析版) 题型:实验题
I、某化学课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题。
(1)写出用硝酸制取NO的离子方程式 。
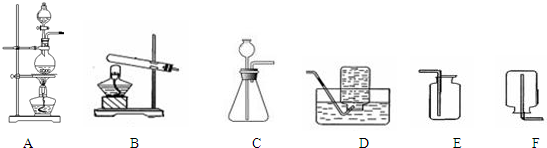
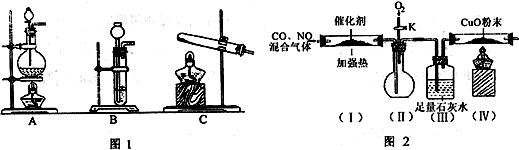
(2)查资料得知,HCOOH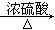 CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
(填序号),实验室利用该装置还可制取的常见气体有 (写一种气体的分子式)。
(3)查资料得知,利用催化剂可使汽车尾气中的一氧化碳和氮氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持和装置已略去)。
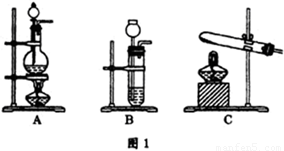

①实验前,关闭旋塞K,先通氮气排净装置中的空气,其目的是 。
②装置(III)的主要作用是 。
③该套装置中有不完善之处,还应在装置(Ⅳ)后补充 装置。
II、该课外小组设计的从ZnSO4、FeCl3的混合溶液中制取ZnSO4·7H2O过程如下:
a.在混合液中加入6 mol/L NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol/L的硫酸,保持溶液的pH在4~6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
d.滤液中加入2 mol/L的硫酸,使其pH=2。
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Fe(OH)3 |
Zn(OH)2 |
|
pH |
1.5~3.2 |
6.4~8.0 |
(1)步骤b中如何检测沉淀已经洗涤干净 。
(2)步骤d中加入硫酸,使其pH=2的目的是 ;要制得ZnSO4·7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐仪器是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山西省高三第一次阶段性诊断考试化学试卷 题型:实验题
(10分)某课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题:
(1) 写出用铜与稀硝酸反应制取一氧化氮的离子方程式: ________________
(2)查阅资料得知: 。实验室有如图所示的装置.则制取一氧化碳可选用的装置为________________(填字母)。
。实验室有如图所示的装置.则制取一氧化碳可选用的装置为________________(填字母)。

(3)汽车尾气是当前城市大气污染的主要来源之一.汽车尾气中的主要污染物为一氧化碳和氮氧化物。汽车尾气催化转化装置可将这些有害气体转化为无害物质。该小组设计了如图所示的装置(部分夹持装置已略去).在实验室模拟汽车尾气处理的过程。

①实验前关闭K2,打开K1从K1处先通氮气排净装置中的空气,其目的是________
②装置III内发生反应的化学方程式为________
③实验过程中,装置V内可观察到的现象是________________
④实验结束后,关闭K1,停止加热,打开K2,通入适量空气后,装置IV中可观察到有红棕色气体生成.该气体是________________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com