
| 物质 | S | S2Cl2 |
| 沸点/℃ | 445 | 138 |
| 熔点/℃ | 113 | -76 |
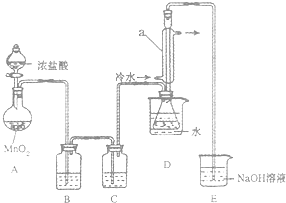 该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:
该小组设计的制备装置如图(夹持仪器已略去),回答下列问题:分析 制取原理是:先是二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混有HCl和水,应该先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,让氯气和硫在一定温度下发生反应:2S+Cl2$\frac{\underline{\;95~100℃\;}}{\;}$S2Cl2,为了控制反应的温度,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可试验中的氯气要进行尾气处理,可以用氢氧化钠来吸收,据此答题.
解答 解:制取原理是:先是二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混有HCl和水,应该先用饱和食盐水除去HCl,再用浓硫酸干燥氯气,让氯气和硫在一定温度下发生反应:2S+Cl2$\frac{\underline{\;95~100℃\;}}{\;}$S2Cl2,为了控制反应的温度,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可试验中的氯气要进行尾气处理,可以用氢氧化钠来吸收,
(1)由于装置中有气体产生和反应,所以连接好实验装置后的第一步实验操作是检查装置的气密性,
故答案为:检查装置的气密性;
(2)浓盐酸与二氧化锰制氯气需要加热,氯气和二硫化碳反应应控制在95~100℃,要用水浴加热,所以实验中需要加热的仪器是AD,
故答案为:AD;
(3)根据上面的分析可知,装置B、C中的试剂分别是饱和食盐水、浓硫酸,
故答案为:饱和食盐水、浓硫酸;
(4)装置D中仪器a是冷凝管,其作用是冷凝回流、导气,
故答案为:冷凝回流、导气;
(5)反应结束后从锥形瓶内混合物主要为S2Cl2和S的混合物,根据题中信息可知,S2Cl2和S的沸点不同,所以从混合物中分离出产品的方法是蒸馏,
故答案为:蒸馏;
(6)若实验过程中缺少C装置,不经过干燥,氯气中有水,S2Cl2与水反应,有黄色单质硫沉淀生成,反应的化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,
故答案为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(7)E烧杯中吸收了氯气的氢氧化钠溶液中含有氯化钠、次氯酸钠,向其中加入浓盐酸,则在酸性环境下,氯离子和次氯酸根离子之间可以发生归中反应得到氯气,反应为:ClO-+2H++Cl-=Cl2↑+H2O,
故答案为:ClO-+2H++Cl-=Cl2↑+H2O.
点评 本题考查了氯气实验室制备方法,杂质气体除杂的装置选择和试剂选择,题干信息的应用分析,电子式书写,化学方程式书写方法,混合物分离的方法判断,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0 L mol/L NaCl溶液中含有Cl-约为6.02×10-23 | |
| B. | 配制一定物质的量浓度的溶液,用浓硫酸配制稀硫酸与用NaOH固体配制NaOH溶液使用的仪器是不同的 | |
| C. | 把1L 2mol/L的盐酸稀释为1mol/L的盐酸需要加入1L的蒸馏水 | |
| D. | 25℃可以配制1.0mol/L的Ba(OH)2溶液[Ba(OH)2•8H2O在293K和303K时的溶解度分别为3.9g和5.6g] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该温度下KOH的溶解度为$\frac{2a}{1-2a%}$g | |
| B. | 原溶液的质量为3mg | |
| C. | 可以求算原溶液的物质的量浓度 | |
| D. | 保持温度不变,向原溶液中加入2a g KOH可达饱和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁全部变成镁离子时失去的电子数为0.1NA | |
| B. | 1.0 mol任何单质气体的分子数均为NA,原子数均为2NA | |
| C. | 17gNH3所含的电子数目为NA | |
| D. | 16g 02和03混合气体中.含有原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com