
【题目】25℃时,下列各组离子在指定溶液中能大量共存的是( )
A.pH =1的溶液中:NH4+、SO42-、ClO-、Na+
B.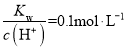 的溶液中:Na+、K+、MnO4-、HCO3-
的溶液中:Na+、K+、MnO4-、HCO3-
C.0.1molL-1的Na2SO3溶液中:H+、K+、SO42-、NO3-
D.澄清透明的溶液中:Fe3+、Na+、Cl-、SO42-
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】一种以含铁废料(含Fe、FeO、Fe2O3以及不溶于酸的杂质)制备黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:

(1)“酸溶”时,硫酸应过量的原因是____和____。
(2)“氧化”的目的是____。不能用酸性KMnO4溶液检验“氧化”后的溶液中是否含有Fe2+,原因是____。(已知氧化性:酸性KMnO4>Cl2>Fe3+)
(3)如图是温度-pH与生成的含铁化合物的关系图,图中阴影部分是黄钠铁矾稳定存在的区域。

①“沉矾”反应的离子方程式为____。
②若“沉矾”反应在80℃时进行,则需控制溶液的pH范围是____。
③“氧化”后的溶液与Na2CO3溶液发生“沉矾”反应时,适宜的混合方式是____(填字母)。
a.将“氧化”后的溶液与Na2CO3溶液同时加入到反应容器中
b.将“氧化”后的溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有“氧化”后的溶液的反应容器中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()

A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积均为0.5L的两个密闭容器中发生:2A(g)+B(g)2C(g)△H=﹣Q kJ/mol (Q>0),6min后,容器①中反应达平衡,有关数据如下表,下列叙述中正确的是
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
A. 0-6min,v(A)=0.25mol/(L·min)
B. ②中达平衡时放出的热量为0.05QkJ
C. 其他条件不变,若容器②保持绝热恒容,则达到平衡时C的体积分数小于2/3
D. 若①达平衡后,再通入1molA与0.5molB,再达平衡时A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
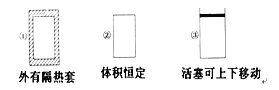
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的各图中,表示2A(g)+B(g)2C(g)(△H<0)这个可逆反应的正确图象为(注:(C)表示C的质量分数,P表示气体压强,C表示浓度)
A.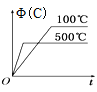 B.
B.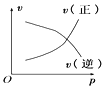 C.
C.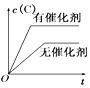 D.
D.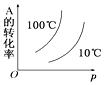
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 在水中的电离方程式为:
在水中的电离方程式为:![]() 。某温度下,向
。某温度下,向![]() 的蒸馏水中加入
的蒸馏水中加入![]() 晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
A.该溶液中![]() 浓度为
浓度为![]()
B.由水电离出来的![]() 的浓度是
的浓度是![]()
C.加入的![]() 的物质的量为
的物质的量为![]()
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(G2762011)规定葡萄酒中SO2最大使用量为0.25g·L1,取300.00mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.0900mol·L-1NaOH标准溶液进行滴定。
(1)滴定前排气泡时,应选择图中的___(填序号)。


(2)若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
a.=10mL b.=40mL c.<10 mL d.>40mL
(3)上述滴定实验中,可选择___为指示剂,选择该指示剂时如何判断反应到达滴定终点:___。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为___g·L1。滴定终点读数时俯视刻度线,则测量结果比实际值___(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com