
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使甲基橙变黄色的溶液中:Na+、Al3+、SO42-、Cl-
B. pH=7的溶液中:K+、Na+、A1O2-、CO32-
C. 与Al反应能放出H2的溶液中:Fe2+、K+、NO3- 、SO42-
D.  =1X10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-
=1X10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图。若上端开口关闭,可得到强还原性的H+(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(烃基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e-=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e-=H·
C. 鼓入空气时,每生成1mol·OH有2mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l) △H。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。下列说法正确的是( )
AsO43-(aq)+2I-(aq)+H2O(l) △H。溶液中c(AsO43-) 与反应时间(t)的关系如图所示。下列说法正确的是( )

A. t1时v逆小于t2时v逆
B. 该反应达到平衡时,2v生成(I-)=v生成(AsO33-)
C. 升高温度,c(AsO33-) 浓度增大,则△H>0
D. 增大c(OH-),平衡向正反应方向移动,平衡常数变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
化学式 | CH3COOH | H2CO3 | HCN | HClO | H2SO3 |
电离常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 5×10-10 | 3.0×10-8 | K1=2×10-2 K2=1×10-7 |
①物质的量浓度均为0.1 mol/L的四种溶液:
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由大到小的顺序为__________(用编号填写)。
②根据上表数据判断,下列离子方程式错误的是__________。
A.CO2(过量)+H2O+ClO-=HCO3-+HClO B.SO2(过量)+H2O+ClO-=HSO3-+HClO
C.CO2(少量)+H2O+CN-=HCO3-+HCN D.SO2(少量)+H2O+CN-=HSO3-+HCN
E.SO2(少量)+2CO32-+H2O=SO32-+2HCO3- F.2SO2(过量)+CO32-+H2O=2HSO3-+CO2↑
③0.10 molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
④25℃时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7)。
⑤25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中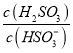 将__________(填“增大”“减小”或“不变”)。
将__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国首个空间实验室——“天宫一号”的供电系统中,有再生氢氧燃料电池(RFC),工作原理如下图所示,a、b、c、d均为Pt电极。

下列说法正确的是
A. B区的OH通过隔膜向a电极移动,A区pH增大
B. c是正极,电极上的电极反应为:2H++2e![]() H2↑
H2↑
C. 图中右管中的OH通过隔膜向c电极移动,d电极上发生氧化反应
D. 当有1 mol电子转移时,标准状况下,b电极理论上产生气体Y的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、下图是全钒液流电池的示意图

该电池充放电的总反应式为:
![]()
请回答下列问题:
(1)充电时的阴极反应式为______________,阳极附近颜色变化是______。
(2)放电过程中,正极附近溶液的pH ________(选填“升高”“降低”或“不变”)。
II、回收利用废钒催化剂(主要成分为V2O5、VOSO4和二氧化硅)的工艺流程如下图所示。

(3)滤渣可用于______________________(填一种用途)。
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表所示:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率(%) | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
根据上表数据判断,加入氨水调节酸碱性,溶液的最佳pH为____;上述过滤操作过程中所需用到的玻璃仪器有__________________________________。
(5)为了提高钒的浸出率,用酸浸使废钒催化剂中的V2O5转变成可溶于水的VOSO4,酸浸过程中,氧化产物和还原产物的物质的量之比为________。
(6)氧化过程中,VO2+变为VO2+,则该反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“ 以烧酒复烧二次……价值数倍也”。请你分析、对比此方法与分离下列物质的实验方法在原理上相同的是
A. 苯和溴苯 B. 硝酸钾和氯化钠 C. 食盐水和泥沙 D. 甲苯和水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com