
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”;G能与NaHCO3溶液反应放出CO2气体。
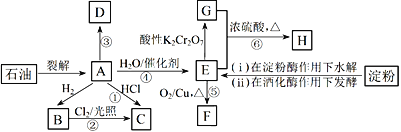
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。
反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
【答案】羟基 加聚反应 c CH2=CH2+H2O![]() CH3CH2OH 2CH3CH2OH+O2
CH3CH2OH 2CH3CH2OH+O2![]() 2CH3CHO+2H2O ① 反应①为加成反应,无副反应发生,原子利用率高
2CH3CHO+2H2O ① 反应①为加成反应,无副反应发生,原子利用率高
【解析】
有机物A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平,则A是乙烯CH2=CH2,A与H2发生加成反应才的B是乙烷CH3CH3,乙烷与Cl2光照反应产生C,A与HCl也发生反应产生C,则C是氯乙烯CH3CH2Cl,A在一定条件下反应产生的D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”;则D是聚乙烯![]() ;乙烯与水发生加成反应产生的E是乙醇CH3CH2OH,乙醇催化氧化产生的F是乙醛CH3CHO;乙醇被酸性K2Cr2O7氧化产生的G是乙酸CH3COOH,乙醇与乙酸发生酯化反应产生的H是乙酸乙酯CH3COOCH2CH3,然后逐一分析解答。
;乙烯与水发生加成反应产生的E是乙醇CH3CH2OH,乙醇催化氧化产生的F是乙醛CH3CHO;乙醇被酸性K2Cr2O7氧化产生的G是乙酸CH3COOH,乙醇与乙酸发生酯化反应产生的H是乙酸乙酯CH3COOCH2CH3,然后逐一分析解答。
根据上述分析可知:A是CH2=CH2,B是CH3CH3,C是CH3CH2Cl,D是![]() ,E是CH3CH2OH,F是CH3CHO;G是CH3COOH, H是CH3COOCH2CH3。
,E是CH3CH2OH,F是CH3CHO;G是CH3COOH, H是CH3COOCH2CH3。
(1)E是CH3CH2OH,官能团是-OH,名称为羟基。反应③是乙烯在一定条件下发生加聚反应产生聚乙烯,乙醇该反应的反应类型加聚反应。
(2) a.B是乙烷,物质分子结构温度,不能被溴水或酸性高锰酸钾溶液氧化,因此不能使溴水或酸性高锰酸钾溶液褪色,聚乙烯分子中也没有不饱和的碳碳双键,也不能使溴水或酸性高锰酸钾溶液褪色,乙烯能与溴水发生加成反应,也能被酸性高锰酸钾溶液氧化,因此可是溶液褪色,a错误;
b.B是乙烷,在烷烃的同系物中,当碳原子数等于4时,可以有丁烷、异丁烷两种不同结构,所以是C≥4时就开始出现同分异构现象,b错误;
c.乙烯与聚乙烯最简式相同,所以等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等,c正确;
故合理选项是c;
(3)反应④是乙烯与水发生加成反应产生乙醇,方程式为:CH2=CH2+H2O![]() CH3CH2OH。
CH3CH2OH。
反应⑤是乙醇催化氧化产生乙醛,反应的方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。
(4)C是氯乙烷,该物质是由分子构成的分子晶体,分子间作用力很小,容易气化。当该物质由液态变为气态时,吸收大量的热,使周围环境温度降低,因此是一种速效局部冷冻麻醉剂,该物质可由反应①或②制备,由①乙烯与HCl发生加成反应产生时,原子利用率是100%,无副反应发生,而反应②除产生氯乙烷外还有HCl产生,会导致大气污染,所以相对来说①反应制备较好。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
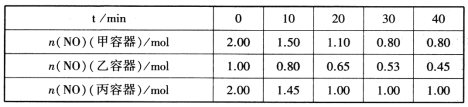
①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
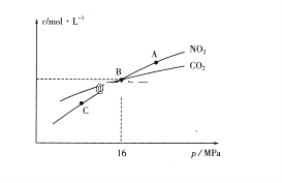
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氧化还原反应的本质是元素化合价的升降
B.氯化钠溶液在电流的作用下电离产生Na+、Cl-
C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
D.得到电子的物质被还原,元素化合价降低,体现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钠和水分别属于非电解质、强电解质和弱电解质
C.点燃的镁条不能在二氧化碳气体中继续燃烧
D.含0.2molH2SO4的硫酸与足量的铜反应,生成标准状况下的气体2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色) ![]() 2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
2CrO42-(黄色)+2H+ 。用K2Cr2O7溶液进行下列实验,结合实验,下列说法不正确的是( )
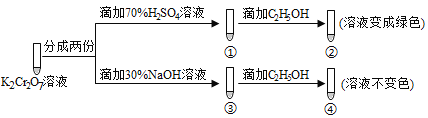
A. ①中溶液橙色加深,③中溶液变黄 B. ②中Cr2O72-被C2H5OH还原
C. 若向④中加入70%H2SO4溶液至过量,溶液变为橙色 D. 对比②和④可知K2Cr2O7酸性溶液氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2O的质量为18g/mol
B. CH4的摩尔质量为16g
C. 3.01×1023个SO2分子的质量为32g
D. 标准状况下,1 mol任何物质体积均为22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com