
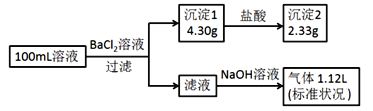
【题目】某100mL溶液可能含有Na+、![]() 、Fe3+、
、Fe3+、![]() 、
、![]() 、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
A.原溶液一定存在 ![]() 和
和![]() ,一定不存在 Fe3+
,一定不存在 Fe3+
B.原溶液可能存在 Cl- 和 Na+
C.原溶液中 c(![]() )是 0.01molL-1
)是 0.01molL-1
D.若原溶液中不存在 Na+,则 c(Cl-)<0.1molL-1
【答案】A
【解析】
加入氯化钡溶液,生成沉淀,一定含有碳酸根或是硫酸根中的至少一种,则该沉淀为BaSO4、BaCO3中的至少一种,沉淀部分溶解于盐酸,所以一定是BaSO4、BaCO3的混合物,一定存在CO32-、SO42-,硫酸钡沉淀是2.33g,硫酸根离子的物质的量是0.01mol,碳酸钡沉淀的质量为4.30-2.33=1.97g,碳酸根离子的物质的量是0.01mol,碳酸根和铁离子不共存,一定不存在Fe3+,所得到的滤液中加入氢氧化钠,出现气体,为氨气,一定含有铵根离子,氨气物质的量为![]() =0.05mol;根据元素守恒,铵根离子的物质的量是0.05mol;根据电荷守恒,阳离子所带正电荷的物质的量之和:0.05mol,阴离子所带负电荷的物质的量之和=0.01×2+0.01×2=0.04mol,所以一定存在氯离子,钠离子不能确定,n(Cl-)≥0.01mol,所以c(Cl-)≥0.1molL-1。
=0.05mol;根据元素守恒,铵根离子的物质的量是0.05mol;根据电荷守恒,阳离子所带正电荷的物质的量之和:0.05mol,阴离子所带负电荷的物质的量之和=0.01×2+0.01×2=0.04mol,所以一定存在氯离子,钠离子不能确定,n(Cl-)≥0.01mol,所以c(Cl-)≥0.1molL-1。
A.根据上面分析,原溶液一定存在 ![]() 和
和![]() ,一定不存在 Fe3+,故A正确;
,一定不存在 Fe3+,故A正确;
B.根据上面分析,原溶液一定存在Cl-,可能存在Na+,故B错误;
C.原溶液中 c(![]() )是
)是![]() =0.1mol/L,故C错误;
=0.1mol/L,故C错误;
D.若原溶液中不存在 Na+,则 c(Cl-)=0.1molL-1,故D错误;
答案:A


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】无机盐X(仅含两种元素)可通过单质甲与Ca(OH)2浊夜共热的方法来制备,某同学为探究X的组成和性质,设计了如下实验(流程图 中部分产物已略去)。
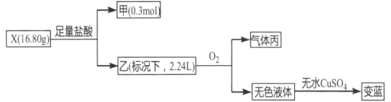
已知:气体乙在标况下的密度为1.52 g·L-1,气体丙无色、有刺激性气味,能使品红溶液褪色。
(1)X的化学式为____,乙的电子式为________
(2)X与足量盐酸反应的化学方程式为___________
(3)在澄清石灰水中通入过量气体丙反应的离子方程式为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.CH4与CO2的混合气体的密度是相同条件下H2密度的14倍,则混合气体中CH4与CO2的分子个数比为_________;
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。
II.根据物质的组成和性质将下列无机化合物进行了分类。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④__________ | ⑤Na2SO4 ⑥K2CO3 | ⑦SO2 ⑧Na2O | ⑨HCl ⑩________ |
(1)请仔细观察表格中的物质类别,从K、H、O、C、N五种元素中任选两种或三种组成合适的弱电解质,将化学式分别填在表中②、④、⑩后面的横线上。
(2)⑦和⑧可发生非氧化还原反应,生成一种盐。该反应的化学方程式为_______;
(3)将⑧的固体加入①的稀溶液中,反应的离子方程式为_______________;
(4)下列关于氧化物的叙述,正确的是_________。
A.金属氧化物一定属于碱性氧化物
B.碱性氧化物一定属于金属氧化物
C.非金属氧化物一定属于酸性氧化物
D.酸性氧化物一定属于非金属氧化物
(5)下列关于酸、碱、盐元素组成的说法中,正确的是_________。
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸(![]() )常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
)常用于有机合成,其合成路线如下,下列有关说法不正确的是( )
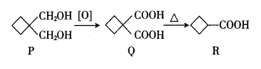
A.R与乙酸互为同系物
B.P、Q、R均能与金属钠反应
C.Q中所有碳原子不可能共平面
D.P的同分异构体中能与NaHCO3溶液反应的结构共有8种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的数值,下列说法正确的是( )
为阿伏加德罗常数的数值,下列说法正确的是( )
A.100g 46%甘油水溶液中含—OH的数目为1.5NA
B.1.7g由NH3与13CH4组成的混合气体中含质子总数为NA
C.0.1molL-1的Al2(SO4)3溶液中含Al3+的数目小于0.2 NA
D.反应CH4 + 2NO + O2 = CO2 + N2 + 2H2O,每消耗标准状况下22.4L NO,反应中转移的电子数目为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)(NH4)2SO4中含有化学键的类型为_________________________。
(2)KNO3中NO3-的立体构型为____________________,其中N原子的杂化方式为________,写出与NO![]() 互为等电子体的另一种阴离子的化学式:_______________。
互为等电子体的另一种阴离子的化学式:_______________。
(3)已知配合物CrCl3·6H2O中心原子Cr3+的配位数为6,向含0.1 mol CrCl3·6H2O的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50 mL,则该配合物的化学式为________________,Cr在基态时,价电子排布式为_____________________。
(4)LiBH4由Li+和BH4-构成,BH4-的立体构型是____________,根据化合物LiBH4判断,Li、B、H的电负性由大到小的顺序为____________。
(5)丙酮(![]() )分子中C原子轨道杂化类型为_____________;含有的π键与σ键数目之比为___________。
)分子中C原子轨道杂化类型为_____________;含有的π键与σ键数目之比为___________。
(6)第一电离能I 1(Zn)______I 1(Cu)(填“大于”或“小于”),原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
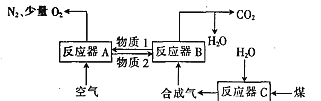
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
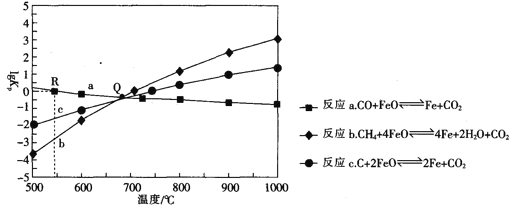
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,对可逆反应A(g)+2B(g)3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗amolA,同时生成3amolCB.C的生成速率与C分解的速率相等
C.容器内压强不再变化D.混合气体的物质的量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I .以下是实验室常用的部分仪器,请回答下列问题:

(1)序号为⑧和⑩的仪器的名称分别为______、______。
(2)在分液操作中,必须用到上述仪器中的____(填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的___(填名称)。
(4)在配制溶液时,需要用到的仪器是________(填序号)。
(5)仪器上标有温度的是____(填序号)。
‖.请选择下列实验方法分离混合物,并将分离方法的序号填在横线上。
A 萃取分液; B 升华; C 结晶 ;D 分液 ;E 蒸馏 ; F 过滤。
(1)___分离饱和食盐水与沙子的混合物。
(2)___从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)____分离水和汽油的混合物。
(4)___分离CCl4和苯(二者互溶)的混合物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com