
| A. | 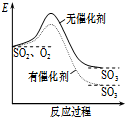 如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| B. | 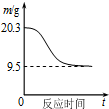 如图表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| C. | 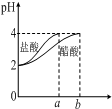 如图表示分别稀释1mLpH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL | |
| D. |  如图表示平衡2NO2(g)?N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化 |
分析 A.催化剂不能改变反应热;
B.MgCl2为强酸弱碱盐,在空气中加热发生水解生成氧化镁;
C.醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离;
D.此反应特点为气体体积减小的反应,缩小体积,即增大压强,平衡右移.
解答 解:A.此图中反应物总能量与生成物总能量差值出现变化,不可能是由于催化剂引起,催化剂不能改变反应的热效应,故A错误;
B.MgCl2为强酸弱碱盐,在空气中加热发生水解生成氧化镁,0.1molMgO的质量为0.1mol×(24+16)g/mol=4.0g,故最终生成质量应为4.0g,故B错误;
C.醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,氯化氢是强电解质,完全电离,导致稀释过程中,醋酸中氢离子浓度大于盐酸,所以pH变化小的为醋酸,且稀释至pH=4,b>100,故C正确;
D.此反应特点为气体体积减小的反应,缩小体积,即增大压强,平衡右移,c(N2O4)变大,与图象中先变大后变小不一致,故D错误;
故选C.
点评 本题主要考查的是化学反应的能量变化规律、弱电解质的电离、平衡移动方向判断等知识,题目难度中等,综合性较强,充分考查了学生的灵活应用能力,注意熟练掌握弱电解质的电离平衡、化学平衡的影响因素,明确化学反应与能量变化的关系.


科目:高中化学 来源: 题型:选择题
| A. | 质子数为78,中子数为117的铂原子:78117Pt | |
| B. | Al3+的结构示意图: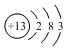 | |
| C. | 次氯酸钠的电子式: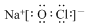 | |
| D. | 碳酸的电离方程式:H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳基硫的电子式: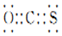 | |
| B. | 乙醛分子的比例模型: | |
| C. | 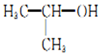 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| D. | 氢化钠与重水反应的化学方程式:NaH+D2O═NaOH+D2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | Y元素在元素周期表中的位置是第2周期第V族 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 已知该步转化过程中的原子利用率为100%,则X为CO2 | |
| B. | 有机物F属于芳香族化合物,但不属于芳香烃 | |
| C. | (C9H8O3)n既是高分子G的化学式也是其链节的化学式 | |
| D. | 已知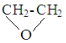 经水解生成乙二醇,则F、G在一定条件下水解,可得相同的产物 经水解生成乙二醇,则F、G在一定条件下水解,可得相同的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13g苯和乙炔(C2H2)的混合物中含有的碳原子数为NA | |
| B. | 过量铁与标准状况下5.6LCl2充分反应,转移电子数为0.75NA | |
| C. | 0.5mol乙烷中含有的共价键数为3NA | |
| D. | 2L0.5mol/L的Na2CO3溶液中含有的CO32-数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2-… |
| A. | 第①组反应的其余产物为H2O | |
| B. | 第③组反应中生成1molCl2,转移电子4mol | |
| C. | 氧化性由强到弱顺序为MnO4->Fe3+>Cl2>Br2 | |
| D. | 第②组反应中Cl2与FeBr2的物质的量之比可能为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol任何气体的体积都约是22.4L | |
| B. | 标准状况下,气体的摩尔体积约是22.4L | |
| C. | 0℃,101kpa时,2gH2的体积约是22.4L | |
| D. | 标准状况下,1mol水的体积约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com