
氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为 。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为 。
(3)下列措施能增强84消毒液杀菌能力的是 。
A.加入适量醋酸 B.加入适量亚硫酸 C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是 。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为 。
(7分)
(1)2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑ (1分)
2NaOH + H2↑+ Cl2↑ (1分)
(2)Cl2 + 2OH-= Cl-+ ClO-+ H2O (1分)
(3)A (1分)
(4)B C(2分,少选得1分,多选、错选不得分)
(5)ClO-+2e-+ H2O→Cl-+2OH-(2分)
【解析】
试题分析:
(1)工业生产通过电解饱和食盐水化学方程式为:2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
(2)氯气与氢氧化钠溶液反应离子方程式:Cl2 + 2OH-= Cl-+ ClO-+ H2O
(3)存在ClO-+ H2O HClO+OH-水解平衡,A ,加入醋酸可以消耗OH-,是平衡正移,增大HClO,正确;B、亚硫酸会与HClO发生氧化还原反应,错误;C、NaOH会增大溶液中OH-的浓度,使平衡逆移,会减小HClO浓度,错误。
HClO+OH-水解平衡,A ,加入醋酸可以消耗OH-,是平衡正移,增大HClO,正确;B、亚硫酸会与HClO发生氧化还原反应,错误;C、NaOH会增大溶液中OH-的浓度,使平衡逆移,会减小HClO浓度,错误。
(4)A、溶液存在电荷守恒:c(Na+) + c(H+) = c(OH-) + c(Cl-)+ c(ClO-),错误;B、由电荷守恒,和溶液呈中性:c(H+) = c(OH-),知c(Na+) = c(ClO-) + c(Cl-),正确;C、根据氯发生歧化反应物料守恒知:c(ClO-) + c(HClO) =c(Cl-),结合c(Na+) = c(ClO-) + c(Cl-),得c(Na+) = 2c(ClO-) + c(HClO),正确。
(5)ClO-的强氧化性会氧化铁,所以正极反应为:ClO-+2e-+ H2O→Cl-+2OH-。
考点:考查电解池、元素及其化合物知识、溶液中离子浓度关系基本化学性质知识。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| △ |
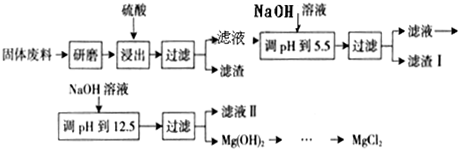
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省高三上学期期中考试理综化学试卷(解析版) 题型:填空题
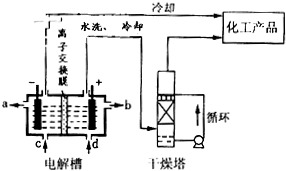
亚氯酸钠(NaC1O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖,油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:
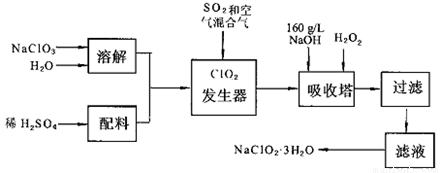
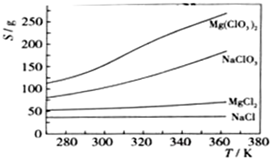
已知:①NaC1O2的溶解度随温度升高而增大,适当条件下可结晶析出NaC1O2·3H2O.
②纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
I.请根据上述流程回答下列问题
(1)发生器中鼓入空气的作用可能是
(2)吸收塔内的反应的化学方程式为 . 吸收塔的温度不能超过20℃,其目的是 .
(3)在碱性溶液中NaC1O2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 .
(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是 .
II.上述流程中的原料NaC1O3可由氯气通入热的烧碱溶液后重结晶就得到比较纯净的产品,所以通常工厂联合氯碱车间制备.
(1)氯碱工业中的原料为 ,原料需要净化的原因是 ,阳极产品为
(2)工业生产NaC1O3的化学方程式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com