
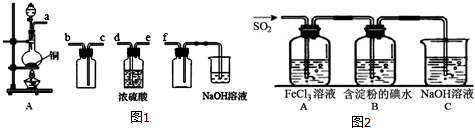
分析 I、(1)利用实验仪器的连接,铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;安全瓶的使用以及尾气吸收来分析;
(2)二氧化硫的验证,利用其特殊性质漂白性来分析.
II、(1)根据装置A反应的离子方程式SO2+2Fe3++2H2O═2Fe2++SO42-+4H+进行解答;B中二氧化硫被碘单质氧化生成硫酸和碘化氢;
(2)蒸发用到蒸发皿、酒精灯、石棉网、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,据此进行解答;
(3)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(4)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,据此书写热化学方程式.
解答 解:I.(1)收集二氧化硫应先干燥再收集,故先通过d、e,二氧化硫的密度比空气大,要从c口进气,b口出来进行尾气处理.因为二氧化硫易于氢氧化钠反应,故f的作用是安全瓶,防止倒吸;盛放NaOH溶液的烧杯为尾气处理装置要放置在最后;
故答案为:d;e;c;b;
(2)检验二氧化硫的一般方法是将气体通入品红溶液中,如果品红褪色,加热后又恢复红色,证明有二氧化硫,
故答案为:将气体通入品红溶液中,如果品红褪色,加热后又恢复红色.
Ⅱ、:(1)装置A中SO2做还原剂,被氧化为硫酸根离子,Fe3+作氧化剂,被还原为Fe2+,反应离子方程式为:SO2+2Fe3++2H2O═2Fe2++SO42-+4H+,则A中反应的现象为:溶液颜色由黄色逐渐变为浅绿色;
B中二氧化硫被碘单质氧化生成硫酸和碘化氢,离子方程式为:I2+SO2+2H2O=2I-+SO42-+4H+;
故答案为:溶液颜色由黄色逐渐变为浅绿色;I2+SO2+2H2O=2I-+SO42-+4H+;
(2)蒸发用到蒸发皿、酒精灯、玻璃棒,过滤用到漏斗、烧杯、玻璃棒,没有用到烧瓶,所以b错误,
故答案为:b;
(3)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,
故答案为:方案①;
(4)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,反应的热化学方程式为:
4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ/mol,
故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)△H=-3408 kJ/mol.
点评 本题考查了气体的实验室制法,要熟练掌握反应原理、发生装置的选择、收集装置的选择.又考查了涉及氧化还原反应的实验,侧重学生分析能力的考查,注意浓硫酸的性质、二氧化硫的检验方法等知识,题目难度中等


科目:高中化学 来源: 题型:选择题
| A. | $\frac{2b-3c}{2a}$ | B. | $\frac{2b-3c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40.5% | B. | 60.6% | C. | 81.0% | D. | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | X 与 Y 的平衡转化率之比为 1:2 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 第二次平衡时,Z 的浓度为 0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
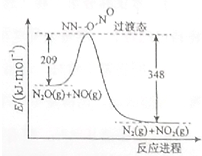 (1)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.
(1)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com