
【题目】废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是___(填字母)
A.热裂解形成燃油 | B.露天焚烧 |
C.作为有机复合建筑材料的原料 | D.直接填埋 |
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中Cu 与H2O2反应生成Cu2+和H2O的热化学方程式为:__________。
(3)控制其它条件相同,印刷电路板的金属粉末用10%H2O2 和3.0mol·L-1
H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜的平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,
其主要原因是_________________________________________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl 溶液,加热,生成
CuCl 的离子方程式是___________________________________。
【答案】BD Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68kJ·mol-1 H2O2分解速率加快 2Cu2++SO32-+2Cl-+H2O![]() 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+
【解析】
(1)A.热裂解形成燃油则可使资源再生利用,所以A正确;
B.露天焚烧会产生污染空气的气体,所以B不符合环保理念;
C.作为有机复合建筑材料的原料也使资源再生利用,所以C正确;
D.直接填埋则可能会造成土壤、水体等污染,所以D不符合环保理念。
(2)根据盖斯定律,将三个方程式加合得:
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H=-319.68kJ·mol-1
(3)由于温度升高,使得一部分H2O2发生分解,导致其浓度减小,所以铜的溶解速率逐渐减小。
(4)根据CuSO4→ CuCl ,则铜的价态降低,则Na2SO3中硫的价态必然降低,剩余反应方程式为:2Cu2++SO32-+2Cl-+H2O![]() 2CuCl↓+SO42-+2H+
2CuCl↓+SO42-+2H+


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.氨水加水稀释后,溶液中c(NH3H2O)/c(NH4+)的值减小,c(H+)增大
B.因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
C.一定温度下,增大反应2BaO2(s)![]() 2BaO(s)+O2(g)容器的体积,平衡不移动
2BaO(s)+O2(g)容器的体积,平衡不移动
D.反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,下列有关电解质溶液的说法正确的是
A. 向NaF溶液中滴加硫酸至中性时,c(SO42-)<c(HF)
B. 稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
C. 向氨水中加入NH4Cl固体,溶液中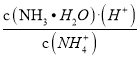 增大
增大
D. 将CH3COONa溶液从20℃升温至30℃,溶液中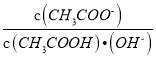 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:![]() 的数据如图所示。下列说法正确的是( )
的数据如图所示。下列说法正确的是( )

A.该反应的![]()
B.达到平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为90%
的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
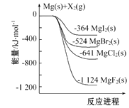
A. 热稳定性:MgF2>MgCl2>MgBr2>MgI2
B. 22.4LF2(g)与足量的Mg充分反应,放热1124kJ
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需要吸收热量
D. 由图可知:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) H=-117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
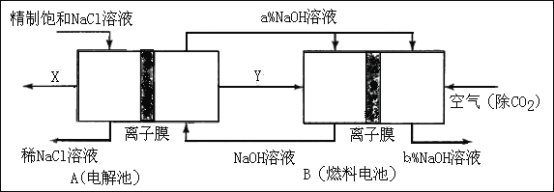
①图中X、Y分别是_____、_______(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______;负极:_____;
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 |
15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是____(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
(2)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)某温度,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
①若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”)。
②下列不能说明该反应已达到平衡状态的是________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
③在一定压强下,容积为V L的容器充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则p1________p2(填“大于”“小于”或“等于”,下同),ΔH________0。
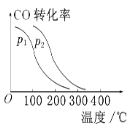
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的有( )
①化学反应除了生成新物质外,还伴随着能量的变化
②放热反应不需要加热就能发生
③需要加热才能发生的反应都是吸热反应
④化学反应放热还是吸热决定于生成物具有的总能量和反应物具有的总能量的大小
⑤热化学方程式应注明反应时的温度与压强,如没注明则表示标准状况时的反应
⑥等量的氢气和氧气分别完全燃烧生成气态水和液态水,前者放出的热量多
⑦H2(g)+I2(g)![]() 2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1molH2和1molI2(g)反应生成2molHI时放出QkJ的热量
2HI(g) ΔH=-QkJ·mol-1表示常温常压下,在恒温密闭容器中当有1molH2和1molI2(g)反应生成2molHI时放出QkJ的热量
⑧同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的ΔH相同
A.2项B.3项C.4项D.5项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种白色固体,常用作杀菌剂、防腐剂。
(1)化学实验小组选用如下装置(部分固定装置略)用钙和氧气制备过氧化钙。

①请选择必要的装置(装置可重复使用),按气流方向连接顺序为__________________。(填仪器接口的字母编号)
②连接好装置进行实验,步骤如下:
I.检查装置气密性后,装入药品;
II._____________________;
III.点燃B处酒精灯加热药品;反应结束后,_______________________________;
Ⅳ.拆除装置,取出产物。
(2)已知化学反应Ca2++H2O2+2NH3+8H2O= CaO2·8H2O↓+2NH4+。在碱性环境中制取CaO2·8H2O的装置如下图:
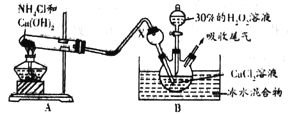
①装置B中仪器X的作用是__________________________________;反应在冰水浴中进行的原因是__________________________________________________________。
②反应结束后,经________、__________、低温烘干获得CaO2·8H2O。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com