
【题目】I. 某可逆反应在某体积为2L的密闭容器中进行,在从0~3min各物质的量的变化情况如图所示(A、B、C均为气体)。

(1)该反应的化学方程式为______。
(2)反应开始至2min时,B的平均反应速率为______。
(3)能说明该反应已达到平衡状态的是______。
A. c(A)= c(B)= c(C) B.容器内压强保持不变
C .v逆(A)= v正(C) D. c(C)不再变化
(4)由图求得A的平衡时的转化率为______。
Ⅱ.(5)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
共价键 | H—H | N—H | N≡N |
能量变化/kJ·mol-1 | a | b | c |
则合成氨反应:N2(g) + 3H2 (g)= 2NH3(g) ![]() H = ______kJ·mol-1
H = ______kJ·mol-1
【答案】2A+B![]() 2C 0.25 mol·L-1·min-1 BCD 0.4(或40%) 3a+c-6b
2C 0.25 mol·L-1·min-1 BCD 0.4(或40%) 3a+c-6b
【解析】
从图中可以看出A和B的物质的量在减少,C的物质的量在增多,所以A和B是反应物,C是生成物。两分钟后A、B、C的物质的量不再改变,所以该反应是一个可逆反应。在两分钟内A的物质的量减少了2mol,B的物质的量减少了1mol,C的物质的量增加了2mol,所以A、B、C的系数比为2:1:2。所以该反应的化学方程式为:2A+B![]() 2C;
2C;
(2)反应开始至两分钟,B的物质的量变化了1mol,那么B的浓度变化了1mol/2L=0.5mol/L,用B表示的平均反应速率为0.5mol/L÷2min=0.25mol/(L·min);
(3)A.各物质的浓度不再变化,可以说明该反应达到平衡状态,而各物质的浓度相等不能说明浓度不再变化,故A不选;
B.该反应是一个反应前后气体系数之和不等的反应,在密闭容器中压强不再变化,说明反应达到了平衡状态,故B选;
C.用A表示的逆反应速率和用C表示的正反应速率相等,而A和C的系数相同,表明正逆反应速率相等,说明达到化学平衡状态,故C选;
D.C的浓度不再变化,说明反应达到平衡状态,故D选。
故选BCD。
(4)在两分钟内到平衡状态时,转化的A是2mol,起始时A是5mol,所以A的转化率是2mol/5mol×100%=40%;
(5)在合成氨反应中,断裂1mol N≡N的同时会断裂3mol H—H,形成6mol N—H。旧键断裂吸收的能量为3a+c,新键形成放出的能量为6b,所以合成氨的![]() H=(3a+c-6b) kJ·mol-1。
H=(3a+c-6b) kJ·mol-1。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1)①-⑦元素中金属性最强的元素位于周期表中的位置为______________________。
(2)③与⑤形成的化合物溶于水会剧烈反应生成白色沉淀和气体A,请写出该反应的化学方程式 ___________________ ,气体A的实验室制备化学方程式为______________。
(3)④所形成的单质与水反应的方程式 _____________,该反应的类型是_______反应。
(4)②、③、⑦的最高价含氧酸的酸性由弱到强的顺序是__________________(用化学式表示);④所在族的各元素与氢气化合所形成的气态氢化物稳定性由强到弱的顺序是(用化学式表示)__________________。
(5)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1。则下列热化学方程式中正确的是
A. ![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l) ΔH=-267 kJ·mol-1
N2(g)+H2O(l) ΔH=-267 kJ·mol-1
B. ![]() N2H4(g)+
N2H4(g)+![]() O2(g) =
O2(g) = ![]() N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
C. 2N2H4(g)+2O2(g)=2N2(g)+4H2O(g) ΔH=-1068 kJ·mol-1
D. N2(g)+2H2O(l) = N2H4(g)+O2(g) ΔH=+534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是( )
A. 用Fe电极电解NaCl溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 四氧化三铁溶于氢碘酸:Fe3O4+8H+ +2I-=3Fe2+ +4H20+I2
C. 碳酸氢钠溶液中加入足量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O
D. 硫酸氢钠溶液与氢氧化钡溶液混合显中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
T | M层上有6个电子 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
用相应的元素符号或化学式回答以下问题
(1)元素X的一种同位素中子数比质子数多1,这种同位素的符号是______。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式______。
(3)元素Z与元素T相比,非金属较强的是______(用元素符号表示)。
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中酸性最强的是______(化学式)
(5)T的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中进行反应:3H2(g) + N2(g)![]() 2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
2NH3(g),经过一段时间后,NH3物质的量增加0.8 mol,这段时间内用N2表示的平均反应速率为0.01 mol·L-1·s-1。则这段时间为
A. 10 sB. 20 sC. 30 sD. 40 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H具有似龙延香、琥珀香气息,香气淡而持久,广泛用作香精的稀释剂和定香剂.合成它的一种路线如图:
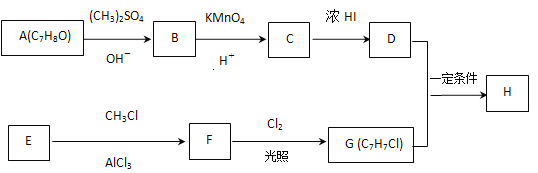
已知以信息:
①![]() ;
;
②核磁共振氢谱显示A的苯环上有四种化学环境不同的氢原子,且取代基的位置相邻;
③在D中滴加几滴FeCl3溶液,溶液呈紫色;
④芳香烃 F的相对分子质量介于90~100之间,0.1 mol F充分燃烧可生成7.2 g水;
⑤R1COOH+RCH2Cl![]() R1COOCH2R+HCl。
R1COOCH2R+HCl。
回答下列问题:
(1)A的化学名称是____,由C生成D的反应的化学方程式为______________。
(2)由F生成G的反应的化学方程式为____________,反应类型为____。
(3)H的结构简式为_________。
(4)苯环上有三个取代基且其中两个与A中所含的官能团相同,同时又能发生银镜反应的C的同分异构体有 (不考虑立体异构)_____种,其中核磁共振氢谱中有5组峰,且峰面积之比为1∶2∶2∶2∶1的同分异构体的结构简式是________(任写一种即可)。
(5)由苯酚和已有的信息经以下步骤可以合成化合物
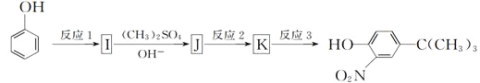
反应1所用的试剂为___,K的结构简式为____,反应3所用的试剂为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“粗食盐的提纯”实验中,用蒸发皿蒸发滤液时,下列操作正确的是
A.把浑浊的滤液倒入蒸发皿里,进行加热
B.等到开始出现固体时,用玻璃棒不断搅拌液体
C.待滤液完全蒸干后,停止加热
D.等到出现大量固体时,停止加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com