
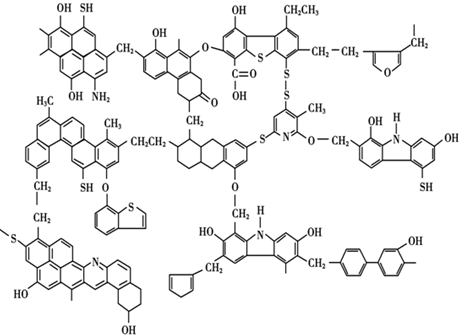
分析 (1)煤的结构模型图有很多苯环;
(2)煤中含有氮硫等元素;
(3)石灰石固硫,实际上是利用CaCO3分解产生的CaO结合SO2,在煤燃烧时生成CaSO4;
(4)煤资源综合利用的方法有煤的干馏、气化、液化等.
解答 解:(1)从煤的结构模型图可以看出,它是工业上芳香烃的重要来源,含有苯和甲苯,
故答案为:苯、甲苯;
(2)煤直接燃烧会产生二氧化硫及氮的氧化物而污染大气,
故答案为:二氧化硫、氮氧化物;
(3)石灰石固硫,实际上是利用CaCO3分解产生的CaO结合SO2,在煤燃烧时生成CaSO4,化学方程式:CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,2CaO+2SO2+O2 $\frac{\underline{\;高温\;}}{\;}$2CaSO4,
故答案为:CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,2CaO+2SO2+O2 $\frac{\underline{\;高温\;}}{\;}$2CaSO4;
(4)煤的干馏、气化、液化等是对煤资源综合利用的重要方法,
故答案为:煤的干馏、煤的气化、煤的液化.
点评 本题考查煤的干馏、气化、液化等,题目难度不大,注意石灰石固硫的原理,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | m=$\frac{36.5V}{22.4}$ | B. | ω=$\frac{36.5c}{1000ρ}$ | ||
| C. | c=$\frac{1000ρV}{36.5V+22400}$ | D. | c=$\frac{V}{22.4+22.4V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于水时,HI分子比HCl分子更容易电离 | |
| B. | HI比HCl熔、沸点都高 | |
| C. | HI比HCl更稳定 | |
| D. | 拆开相同物质的量的HI分子比HCl消耗的能量小,HI是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
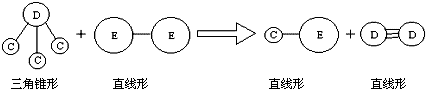
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 少量碳酸钠固体 | B. | 少量硫酸铜固体 | C. | 硝酸钾溶液 | D. | 氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
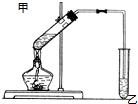 如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,再加入2克无水乙酸,充分摇匀,并在摇动下缓缓加入2mL浓硫酸,冷却后,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答: CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
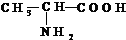 ,请回答下列问题.
,请回答下列问题. .
. 为:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5.
为:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述不正确的是( )
拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述不正确的是( )| A. | 属于芳香化合物 | B. | 属于卤代烃 | ||
| C. | 具有酯类化合物的性质 | D. | 在一定条件下可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
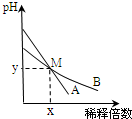 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前两溶液中H+浓度的大小关系:A=10B | |
| B. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7 mol/L | |
| C. | 取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗酸溶液的体积相同 | |
| D. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com