
分析 (1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,根据热化学方程式的书写方法来回答;
(2)常温下某溶液中由水电离产生的c(H+)=10-10 mol/L,说明水的电离被抑制,可能是酸溶液,也可能是碱溶液;
(3)氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1反应,设出硫酸氢钠溶液的体积为x,结合反应前后溶液pH变化列式计算出x,从而可知Ba(OH)2溶液与NaHSO4溶液的体积比;最后根据c=$\frac{n}{V}$计算出硫酸氢钠溶液的浓度;
(4)氯化铵溶液中铵根离子水解溶液显酸性;写出氨水电离方程式,计算出离子浓度,代入电离平衡常数表达式计算氨水的电离平衡常数.
解答 解:(1)甲醇的燃烧热为486kJ/mol,依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-486kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-486kJ•mol-1;
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离,常温下,kw=c(H+)×c(OH-)=1×10-14,纯水中c(H+)=1×10-7 mol•L-1,该溶液中由水电离产生的c(OH-)=1×10-10mol•L-1<1×10-7 mol•L-1,说明该溶液抑制水电离,所以该溶液可能是酸也可能是碱,如果是酸溶液,则溶液中氢离子浓度是0.0001mol/L,溶液的pH=4,如果是碱溶液,则溶液中氢原子浓度是1×10-10 mol•L-1,溶液的pH=10,
故答案为:4或10;
(3)VL pH=12的Ba(OH)2溶液中c(OH-)=10-2mol/L,含有的氢氧根离子物质的量为V×10-2mol=0.01Vmol,溶液中的Ba2+恰好完全沉淀时反应的硫酸氢钠物质的量为0.5V×10-2mol=0.005Vmol,设硫酸氢钠溶液体积为x,依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,反应后的溶液中氢氧根离子浓度为:c(OH-)=10-3mol/L,则:$\frac{0.01Vmol-0.005Vmol}{(x+V)L}$=10-3,解得:x=4VL,则Ba(OH)2溶液与NaHSO4溶液的体积比为VL:4VL=1:4;该硫酸氢钠溶液的浓度为:$\frac{0.005Vmol}{4VL}$=0.00125mol/L,
故答案为:1:4;0.00125mol/L;
(4)在0.5mol/LNH4Cl溶液中,pH=5.显酸性,是由于铵根离子水解溶液显酸性,离子方程式为:NH4++H2O?NH3•H2O+H+,氨水为弱碱,一水合氨在溶液中部分电离出氢氧根离子,其电离方程式为:NH3•H2O?NH4++OH-;故c(NH3•H2O)=c(H+)=1×10-5mol/L,则c(OH-)=$\frac{{K}_{W}}{C({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,c(NH4+)=0.5mol/L-1×10-5mol/L≈0.5mol/L,氨水的电离方程式为:NH3•H2O?NH4++OH-电离平衡常数Kb(NH3•H2O)=$\frac{C(N{{H}_{4}}^{+})•C(O{H}^{-})}{C(N{H}_{3}•{H}_{2}O)}$,
把以上数据代入平衡常数表达式:Kb(NH3•H2O)=$\frac{0.5mol/L×1{0}^{-9}mol/L}{1{0}^{-5}mol/L}$=5×10-5mol/L,
故答案为:NH4++H2O?NH3•H2O+H+;5×10-5mol/L.
点评 本题考查了热化学方程式的书写方法、pH的计算、盐类的水解、电离平衡常数的计算知识,属于综合知识的考查,题目难度中等,明确溶液中氢氧根离子浓度和溶质浓度的关系是解题关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法.


科目:高中化学 来源: 题型:选择题
| A. | ClO-中氯元素显+1价,具有很强的还原性 | |
| B. | 这些离子结合H+的能力,ClO4-最强 | |
| C. | ClO3-是NO3-的等电子体,其空间构型为平面三角形 | |
| D. | ClO2-、ClO3-、ClO4-中的氯原子都采取sp3杂化,离子中相邻两个Cl-O键间键角依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
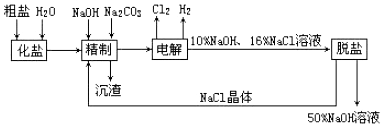
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
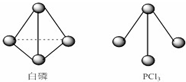 ①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.
①已知0.4mol液态肼(N2H4)和足量H2O2反应,生成氮气和水蒸气时放出256.65kJ的热量.写出该反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入稀硫酸 NH3+H+═NH4+ | |
| B. | 稀烧碱溶液和氯化铵溶液混合 NH4++OH-═NH3•H2O | |
| C. | 碳酸氢铵和足量浓烧碱溶液混合加热 NH4++OH-═NH3↑+H2O | |
| D. | Cl2和水反应 Cl2+H2O═H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | AgNO3应保存在棕色瓶中,放在低温避光处 | |
| B. | 氨气用浓硫酸干燥 | |
| C. | 常用湿润淀粉碘化钾试纸检验Cl2 | |
| D. | NO能用排空气法收集 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com