
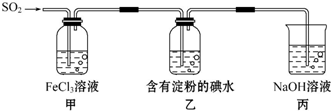
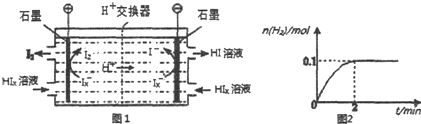
| A. | 为了验证Fe3+被SO2还原得到Fe2+,可向甲中加入KMnO4溶液,看紫红色是否褪去 | |
| B. | 甲中加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀说明SO2可以被Fe3+氧化 | |
| C. | 能表明I-的还原性弱于SO2的现象是乙中蓝色溶液褪色 | |
| D. | 装置丙的作用是吸收SO2尾气,防止污染空气 |
分析 A.二氧化硫、亚铁离子都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色.
B.铁离子氧化二氧化硫为硫酸,加入氯化钡生成沉淀说明反应进行;
C.乙中蓝色褪去,说明二氧化硫和碘单质反应,依据氧化还原反应中还原剂的还原性大于还原产物分析;
D.二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收;
解答 解:A.二氧化硫、亚铁离子都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色,不能验证Fe3+被SO2还原得到Fe2+,发生了氧化还原反应,故A错误;
B.铁离子氧化二氧化硫为硫酸,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,加入氯化钡生成沉淀说明反应进行生成了硫酸根离子,SO2可以被Fe3+氧化,故B正确;
C.乙中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故C正确;
D.二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,故D正确;
故选A.
点评 本题考查了二氧化硫、铁及其化合物性质分析判断,氧化还原反应比较方法,掌握基础是关键,题目难度中等.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:填空题
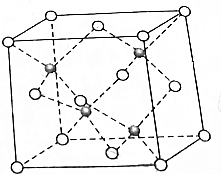 Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu,
Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu, 为F)
为F)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
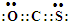 .
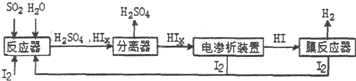
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| B. | 向淀粉溶液中加入稀硫酸并加热片刻,然后再加入适量银氨溶液进行水浴加热,没有银镜生成,说明淀粉没有水解 | |
| C. | 将二氧化硫气体通入到高锰酸钾酸性溶液中,溶液紫红色褪去,说明二氧化硫有漂白性 | |
| D. | 向碳酸钠溶液中滴加几滴酚酞试液,然后再加入氯化钡溶液,溶液红色褪去,说明碳酸钠溶液中存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 条件 | 离子组 | 共存所发生的离子反应方程式 |
| A | pH=1的溶液 | Fe2+、Al3+、Cl-、MnO4- | 10Cl-+2MnO4-+16H+═2Mn2++5Cl2↑+8H2O |
| B | 能与铝反应生成氢气的溶液 | K+、NO3-、Cl-、NH4+ | NH4++OH-═NH3•H2O |
| C | 常温下c(H+)/c(OH)-=10-10的溶液 | Na+、Cl-、S2-、SO32- | SO32-+2S2-+6H+═3S↓+3H2O |
| D | 含有大量H+的透明溶液 | Na+、Cu2+、AlO2-、SiO32- | 2H++SiO32-═H2SiO3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸:CH3-CHOH-COOH | |
| B. | 甘油:CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖:CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖:CH2OH-CHOH-CHOH-CHOH-CHO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com