
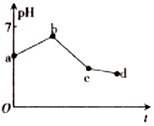
 用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是( )
用石墨作电极电解KCl和CuSO4(等体积混合)混合溶液,电解过程中溶液pH随时间t的变化如图所示,下列说法正确的是( )| A. | ab段H+被还原,溶液的pH 增大 | |
| B. | cd 段相当于电解水 | |
| C. | c点时加人适量CuCl2固体,电解液可恢复原来浓度 | |
| D. | 原溶液中KCl和CuSO4的物质的量浓度之比为2:1 |
分析 用惰性电极电解相等体积的KCl和CuSO4混合溶液,溶液中存在的离子有:K+,Cl-,Cu2+,SO42-,H+,OH-
阴极离子放电顺序是Cu2+>H+,阳极上离子放电顺序是Cl->OH-,电解过程中分三段:
第一阶段:阳极上电极反应式为2Cl--2e-═Cl2↑、阴极电极反应式为Cu2++2e-═Cu,铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升;
第二阶段:阳极上电极反应式为4OH--4e-═2H2O+O2↑(或2H2O-4e-═4H++O2↑),阴极反应先发生Cu2++2e-═Cu,反应中生成硫酸,溶液pH降低;
第三阶段:阳极电极反应式为4OH--4e-═2H2O+O2↑、阴极电极反应式为2H++2e-═H2↑,实质是电解水,溶液中硫酸浓度增大,pH继续降低.
据此分析解答.
解答 解:ab段由于铜离子浓度减小,水解得到氢离子浓度减小,溶液pH上升,氢离子为被还原,故A错误;
B.cd段pH降低,此时电解反应参与的物质为H+,OH-,H2O,电解反应相当于电解水,故B正确;
C.电解至c点时,溶液中溶质为硫酸、硫酸钾,往电解液中加入适量CuCl2固体,不能使电解液恢复至原来的浓度,故C错误;
D.图象中具体数量关系未知,不能原混合溶液中KCl和CuSO4的浓度之比,故D错误.
故选B.
点评 本题考查电解原理,明确离子放电顺序是解本题关键,根据电解过程中溶液中氢离子浓度变化判断发生的反应.本题设计到的电解反应较多,需结合图象分析每一段变化所对应的电解反应,考查分析能力,难度较大,属于难题.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ①⑤ | C. | ③⑧ | D. | ③⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C昜被氧化,当新鲜蔬菜煮熟后,所含维生素C会有所损失 | |
| B. | 钢筋混凝土属复合材料 | |
| C. | 光导纤维和计算机芯片的主要材料都是单质硅 | |
| D. | 生产水泥、玻璃、熟石灰都要用到石灰石这一原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与NaAlO2溶液混合生成白色沉淀,说明结合H+的能力:AlO2->CO32- | |
| B. | 将SO2通入酸性KMnO4溶液中溶液褪色,不能说明SO2具有漂白性 | |
| C. | 工业上制钾的反应为Na+KCl (熔融)=NaCl+K↑,说明还原性Na比K强 | |
| D. | 亚硫酸是良好的还原剂,浓硫酸是良好的氧化剂,但两者混合,却不发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 氯化硼中心原子采用sp杂化 | |
| C. | 氯化硼分子与氯化铝分子互为等电子体,都是非极性分子 | |
| D. | 氯化硼的熔沸点与氯硼键的键能大小有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不粘锅涂层为有机高分子材料,分子中含碳碳双键 | |
| B. | 聚四氟乙烯是由不饱和烃加聚得到的 | |
| C. | 聚四氯乙烯中氟的质量分数为76% | |
| D. | 聚四氟乙烯的化学活动性较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某有机物由C、H、O三种元素组成,球棍模型如图所示:
某有机物由C、H、O三种元素组成,球棍模型如图所示: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com