
燃料电池具有能量转化交率高等优点,具有很好的发展前景。有一种燃料电池,用石墨做电极,电解质溶液是KOH溶液,在两极上分别通入乙烷气体和氧气。请写出电极反应和电池总反应。
科目:高中化学 来源: 题型:

| ||
| ||


温度(K) CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 污染成分 | 天然气火力发电 | 重油火力发电 | 煤火力发电 | 燃料电池 |
| SO2 | 2.5~230 | 4550 | 8200 | 0~0.12 |
| NOx | 1800 | 3200 | 3200 | 63~107 |
| 烃类 | 20~1270 | 135~5000 | 30~10000 | 14~102 |
| 尘末 | 0~90 | 45~320 | 365~680 | 0~0.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池。右图是一个乙醇燃料电池工作时的示意图。乙池中的两个电极均为石墨电极,乙池中盛有100mL3.00mol/L的CuSO4溶液。请回答下列问题:
(1)N的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气 L(标准状况下)。
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇 g。
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K= ,
②条件相同时,反应I与反应II相比,转化程度更大的是 。
③在一定压强下,测得反应I的实验数据如下表:
根据表中数据分析:
温度升高,K值 (填“增大”、“减小”或“不变”),提高氢碳比。n(H2)/n(CO2),对生成乙醇 (填“不利”或“有利”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江哈三中高三第三次模拟考试(理综)化学部分 题型:填空题
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池。右图是一个乙醇燃料电池工作时的示意图。乙池中的两个电极均为石墨电极,乙池中盛有100mL3.00mol/L的CuSO4溶液。请回答下列问题:

(1)N的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气 L(标准状况下)。
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇 g。
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)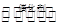 CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g)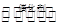 CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K= ,
②条件相同时,反应I与反应II相比,转化程度更大的是 。
③在一定压强下,测得反应I的实验数据如下表:
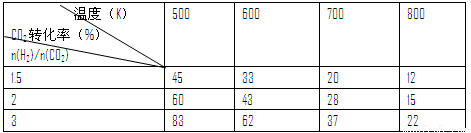
根据表中数据分析:
温度升高,K值 (填“增大”、“减小”或“不变”),提高氢碳比。n(H2)/n(CO2),对生成乙醇 (填“不利”或“有利”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com