
【题目】下列有关说法正确的是
A.MgO(s)+C(s)=CO(g)+Mg(g)高温下能自发进行,则该反应ΔH>0、ΔS>0
B.常温下等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C.0.1 mol·L-1 NH4Cl溶液加水稀释,![]() 的值增大
的值增大
D.对于反应2SO2+O22SO3,使用催化剂能加快反应速率并提高SO2的平衡转化率
【答案】A
【解析】
A.当△G=△H-T△S<0时反应能自发进行,反应MgO(s)+C(s)=CO(g)+Mg(g)的△S>0,高温下能自发进行,则该反应ΔH>0,故A正确;
B.等物质的量浓度的CH3COOH溶液和HCl溶液,HCl溶液中氢离子浓度大,对水的电离的抑制程度大,所以等物质的量浓度的CH3COOH溶液和HCl溶液中水的电离程度不同,故B错误;
C.0.1mol/LNH4Cl溶液加水稀释,NH4++H2ONH3H2O+H+,促进铵根离子的水解,水解平衡正移,溶液中氯离子浓度减小,一水合氨浓度增大,![]() 的值减小,故C错误;
的值减小,故C错误;
D.对于反应2SO2+O22SO3,使用催化剂能加快反应速率,但平衡不移动, SO2的平衡转化率不变,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】向Ba(OH)2和NaOH的混合稀溶液中通入足量的CO2气体,生成沉淀的物质的量(n)和通入CO2气体体积(V)的关系如下图所示,试回答:

(1)a点之前的反应的离子方程式为________________。
(2)a点到b点之间的反应的离子方程式是________________、________________。
(3)c点二氧化碳体积是________L。
(4)混合稀溶液中Ba(OH)2和NaOH的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:
Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al | |
罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | - | - | - | 其余 |
罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | - | 0.1 | 0.25 | 其余 |
拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
为了验证罐身的组成成分,进行了如下实验:
(实验仪器与药品)
仪器:酒精灯、烧杯、试管、试管夹、漏斗、滤纸、铁圈、玻璃棒、砂纸、剪刀
药品:易拉罐、去污粉、NaOH溶液、KSCN溶液、盐酸、镁试剂、高碘酸(H5IO6,弱酸)
(实验方案)
实验预处理。将剪好的易拉罐片用砂纸打磨,除去表面的涂料层,直到光亮后用去污粉清洗干净备用。
(实验过程)分别向试管a、b中加入少量上述易拉罐片,进行如下操作:

请填写下列空白:
(1)图中操作①②所用到的玻璃仪器有______________________________。
(2)沉淀A的成分为________。
(3)操作③观察到的现象为_____________________________________;反应的离子方程式为____________________________________________。
(4)若试管a、b中取样量相等,则分别加入过量的NaOH溶液、稀盐酸后,相同条件下理论上产生的气体体积V(a)________V(b)(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:C2H5CH=CHCH3+CH2=CH2![]() C2H5CH=CH2+CH2=CHCH3
C2H5CH=CH2+CH2=CHCH3
现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:

(1)按系统命名法,有机物A的名称是_______。
(2)B的结构简式是__________。
(3)C![]() D的反应类型是___________。
D的反应类型是___________。
(4)写出D![]() M的化学方程式________。
M的化学方程式________。
(5)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为_______。
(6)满足下列条件的X的同分异构体共有_______种,写出任意一种的结构简式_________。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
(7)写出E![]() F合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)。______
F合成路线(用结构简式表示有机物,箭头上注明试剂和反应条件)。______
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步操作采取的分离方法是___。
(2)根据上述框图反应关系,写出下列B、C、E所含物质的化学式
沉淀固体B___;C___;E___
(3)写出①、④四个反应方程式(是离子反应的写离子方程式)
①___;④___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是( )
A.用K3[Fe(CN)6]检验Fe2+的离子反应方程式:2Fe(CN)63- + 3Fe2+= Fe3[Fe(CN)6]2 ↓
B.含氟牙膏防治龋齿的原理是氟离子会跟羟基磷灰石发生沉淀转化生成氟磷灰石的离子反应方程式:Ca5(PO4)3(OH) +F- ![]() Ca5(PO4)3F +OH -
Ca5(PO4)3F +OH -
C.用TiCl4制备TiO2的化学方程式:TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl
TiO2·xH2O↓+4HCl
D.已知在重铬酸钾溶液中存在着如下平衡:Cr2O72-+ H2O![]() H++ 2CrO42-
H++ 2CrO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:
=10-12的溶液中:![]() 、Cu2+、
、Cu2+、![]() 、
、![]()
B.滴加KSCN溶液显红色的溶液中:![]() 、K+、Cl-、I-
、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、![]()
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种无机物之间的转化关系如下图所示(反应条件省略,部分产物省略)。下列推断不正确的是( )

A.若L为强碱,则E可能为NaCl溶液、F为K
B.若L为强酸,则E可能为Na2S、F为H2O2
C.若L为弱酸,则E可能为Mg、F为CO2
D.若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表回答下列有关问题.
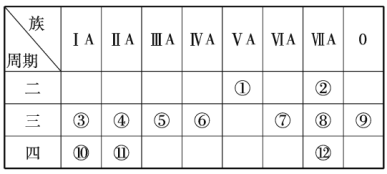
(1)写出下列元素符号:①______,⑥______,⑦______,______.
(2)这些元素中最活泼的金属元素是______(填元素符号,下同),最活泼的非金属元素是______,最不活泼的元素是______.
(3)这些元素的最高价氧化物对应的水化物中酸性最强的是______(填化学式,下同),碱性最强的是______,呈两性的氢氧化物是______,写出三者之间两两反应的化学方程式:______;______;______.
(4)这些元素(除0族元素外)中原子半径最小的是______(填元素符号,下同),原子半径最大的是______.
(5)在③与④中,单质的化学性质较活泼的是______(填元素符号),怎样用化学实验证明?______在⑧与中,单质的化学性质较活泼的是____________(填元素符号),怎样用化学实验证明?_____________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com