
| 6g |
| 12g?mol-1 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 | ||||
| B、核外电子排布相同的微粒化学性质也相同 | ||||
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 | ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
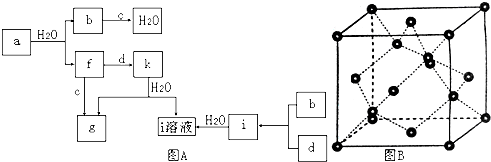
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
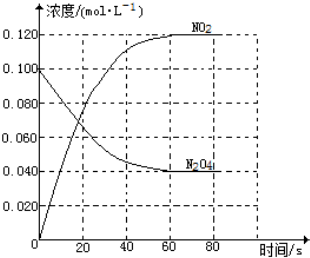 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:
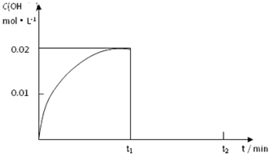 I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)
I.制取三氧化硫反应的化学方程式为:2SO2(g)十O2(g)| 加热 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 元素性质或原子结构 |
| X | 原子的最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
| T | 与Z同周期,元素最高价是+7价 |
| W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解.
如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com