
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

(1)固体I中主要成分为__________,捕获剂所捕获的气体主要是_________。
(2)处理含NH4+废水时,发生反应的离子方程式为___________。
(3)若X为适量空气,严格控制空气用量的原因是____________。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________。
增加压强,NO的转化率__________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________(填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________。
【答案】 CaCO3 CaSO3 Ca(OH)2 CO NH4++NO2-=N2+2H2O 过量空气会将NO氧化成NO3-,无法与NH4+发生反应 4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O 提高 减小 Ca2+与SO42-结合生成CaSO4沉淀,使平衡向产物方向移动,SO2转化率提高
【解析】工业废气中CO2、SO2可被石灰水吸收,生成CaCO3、CaSO3,气体a是不能被过量石灰水吸收的N2、NO、CO,气体a通入空气,用氢氧化钠溶液处理后到的NaNO2,通入空气但不能过量,否则得到硝酸钠,NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,则气体b含有CO、N2,经捕获剂得到氮气,防止污染空气,因此捕获剂所捕获的气体主要是CO。
(1)工业废气中CO2、SO2可被石灰水吸收,生成CaCO3、CaSO3,因氢氧化钙过量,则废渣的成分为主要含有CaCO3、CaSO3、Ca(OH)2,气体b含有CO、N2,捕获剂所捕获的气体主要是CO,故答案为:CaCO3、CaSO3、Ca(OH)2;CO;
(2)NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,发生氧化还原反应,离子方程式为:NH4++NO2-=N2↑+2H2O,故答案为:NH4++NO2-=N2↑+2H2O;
(3)由分析可知,气体1是不能被过量石灰水吸收的N2、NO、CO,气体a通入空气,用氢氧化钠溶液处理后到的NaNO2,通入的空气不能过量,过量空气会将NO氧化成NO3-,无法与NH4+发生反应,故答案为:过量空气会将NO氧化成NO3-,无法与NH4+发生反应;
(4)①亚氯酸钠具有氧化性,且NaClO2溶液呈碱性,则NaClO2溶液脱硝过程中主要反应的离子方程式为3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O;正反应是体积减小的反应,则增加压强,NO的转化率提高,故答案为:3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O;提高;
②根据反应的方程式3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O可知随着吸收反应的进行氢氧根离子被消耗,吸收剂溶液的pH逐渐降低,故答案为:减小;
③如果采用NaClO、Ca(ClO)2替代NaClO2,生成硫酸钙沉淀,降低硫酸根离子浓度,促使平衡向正反应方向进行,所以Ca(ClO)2效果好,故答案为:形成CaSO4沉淀,降低硫酸根离子浓度,反应平衡向产物方向移动,SO2转化率提高。


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】起固氮作用的化学反应是( )
A. 工业上将氨转化成硝酸和其他氮的氧化物 B. 硝酸工厂用NH3制NO
C. 雷雨时空气中的N2转化为NO D. 由NH3制碳酸氢铵和硫酸铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铁与氯化铁溶液反应:Fe+Fe3+===2Fe2+
B. 向次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO
C. 实验室用MnO2和浓盐酸制取Cl2: MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
D. 向NH4HCO3溶液中加过量的NaOH溶液:NH![]() +OH-===NH3↑+H2O
+OH-===NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定X的成分,设计并完成如下实验:
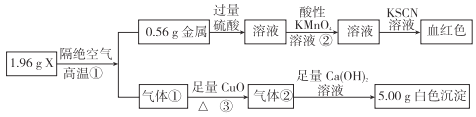
请回答:
(1)X的化学式是___________。
(2)反应②的离子方程式:___________。
(3)反应①的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 少量 SO2通入过量次氯酸钠溶液中:SO2+ ClO-+H2O===SO![]() +Cl-+2H+
+Cl-+2H+
B. 钠投入硫酸铜溶液中:2Na + Cu2+===Cu + 2Na+
C. 碳酸氢钠与氢氧化钠溶液混合:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
D. 硫酸镁溶液与氢氧化钡反应:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA
B. 0.1 mol·L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA
C. 足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA
D. 常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式书写正确的是 ( )
A. Al2(SO4)3===2Al3++3SO![]() B. Cu(OH)2===Cu2++2OH-
B. Cu(OH)2===Cu2++2OH-
C. NaHSO4===Na++HSO![]() D. (NH4)2SO4===NH
D. (NH4)2SO4===NH![]() +SO
+SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、配平下列方程式:
____MnO![]() +____H++____Cl- === ____Mn2++____Cl2↑+____H2O
+____H++____Cl- === ____Mn2++____Cl2↑+____H2O
____H2S+____HNO3 ===____S↓+____NO↑+____H2O
II、KClO3 和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其化学方程式为:
2KClO3 +4HCl(浓)=== 2KCl+2ClO2↑+Cl2↑+2H2O
(1)浓盐酸在反应中表现出来的性质是____(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)产生 0.1molCl2,则转移电子的物质的量为____mol。
(3)用单线桥法标出该反应的电子转移的方向和数目。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com