
关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子
B.按Li、Na、K、Rb、Cs的顺序,单质熔沸点升高,密度增大
C.随核电荷数递增,氢氧化物碱性增强
D.随电子层数增加,原子半径增大,金属还原性增强
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
一定条件下反应N2(g)+3H2(g)⇌2NH3(g)在2L的密闭容器中进行,测得2min内,N2的物质的量由2mol减小到0.4mol,则2min内N2的反应速率为( )
|
| A. | 0.4mol/L•min | B. | 0.8mol/(L•min) | C. | 1.6mol/L•min | D. | 0.4mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+: Cu2+(aq)+MnS(s)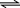 CuS(s)+Mn2+(aq),下列说法错误的是 ( )
CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A.相同条件下,MnS的Ksp比CuS的Ksp大
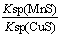 B.该反应的平衡常数K=
B.该反应的平衡常数K=
C.该反应达到平衡时c(Mn2+)=c(Cu2+)
D.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO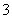 的水解程度增大,故碱性增强,该反应的离子方程式为____________________________________。乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3。
的水解程度增大,故碱性增强,该反应的离子方程式为____________________________________。乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3。
(2)丙同学认为甲、乙的判断都不充分。
丙认为:只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清的石灰水
(3)将加热后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(4)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)的判断是错误的,理由是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生设计一水果电池:他把一铁钉和碳棒用导线连接好,然后将铁钉和碳棒平行插入一新鲜西红柿中,再在导线中接一个灵敏电流计.据此下列叙述正确的是 ( )
A.电流计指针不会发生偏转
B.金属铁会被腐蚀
C.碳棒作负极
D.铁表面有气体逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com