
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
A.它是副族元素
B.它是第六周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年四川省资阳市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。

Ⅰ、ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;
b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2。
(1)②中使用的氧化剂最好是下列的 (选填字母代号)。
A.Cl2 B.浓HNO3 C.KMnO4 D.H2O2
(2)为了达到综合利用、节能减排的目的,上述流程步骤④中的CO2可以来自于步骤 (选填①、②、③、⑤)。
(3)写出步骤④后产生滤渣3的化学式 。
(4)与Al相似,Zn也能溶于NaOH溶液。写出将Zn片和Cu片放入NaOH溶液中形成原电池的负极电极反应式: 。
Ⅱ、BaS溶液的制备:
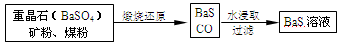
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH1=-1473.2 kJ·mol-1
C(s)+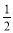 O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
Ba(s)+S(s)=BaS(s) ΔH3=-460 kJ·mol-1
(5)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为: 。
Ⅲ、制取锌钡白:
(6)如果生产流程步骤⑤硫酸过量,则ZnSO4与BaS溶液混合制取锌钡白产生的后果是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.分子式为C10H12O2的有机物,①苯环上有两个取代基,②能与NaHCO3反应生成气体,满足以上2个条件的该有机物的同分异构体有15种
B.对苯二甲酸(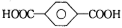 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维
)与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维
(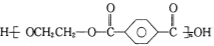 )
)
C.分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种
D.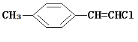 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:填空题
(9分)
(1)请用下列10种物质的序号填空:①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是______________________________________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:
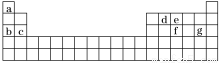
①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
A.c和f B.b和g C.d和g D.b和e
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素。下列说法中,错误的是
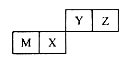
A.Y元素气态氢化物的稳定性大于Z元素的
B.M和Y两种元素,可以形成电子层结构相同的两种简单离子
C.X元素最高价氧化物对应水化物的酸性弱于Y元素的
D.M元素的氧化物既可以与酸溶液反应,也可以与碱溶液反应
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
aXn-和bYm+为短周期两元素的离子, 它们的电子层结构相同, 下列判断错误的是
A.原子半径X<Y B.a+n=b-m
C.Y最高价氧化物的化学式为YOm D.X的氢化物的化学式为HnX
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市奉贤区高三第二学期调研测试化学试卷(解析版) 题型:推断题
(本题共10分)碳碳双键的性质较为活泼,在一定条件下会发生特殊的反应,例如: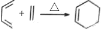 。根据下列转化流程,回答43-46题:
。根据下列转化流程,回答43-46题:
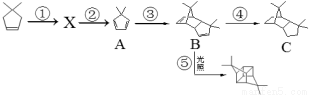
43.反应条件:② ,③ 。
44.反应类型:① ,⑤ 。
45.结构简式:X 。
46.写出实验室由B的芳香烃的同分异构体的同系物制备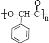 的合成路线: 。
的合成路线: 。
(合成路线常用的表示方式为: )。
)。
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市奉贤区高三第二学期调研测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.乳酸薄荷醇酯(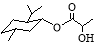 )只能发生水解、氧化、消去反应
)只能发生水解、氧化、消去反应
B.乙醛和丙烯醛不是同系物,它们的氢化产物也一定不是同系物
C.分子式为C7H14O2的有机物中,含3个甲基且能发生银镜反应还能发生水解反应的同分异构体数目是8个
D.硝化甘油、硝化纤维、硬脂酸甘油酯两两互不为同分异构体,其水解产物也完全不相同
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省张掖市高三4月诊断考试理综化学试卷(解析版) 题型:实验题
(14分)肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)+2NaOH+NaClO = Na2CO3+N2H4·H2O+NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是 ;
实验二:制取水合肼(实验装置如图所示)
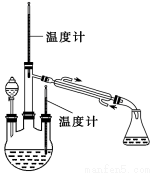
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO = N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是 (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是 ;
实验三:测定馏分中肼含量
水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000 g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250 mL溶液。
b.移取25. 00 mL于锥形瓶中,加入10 mL水,摇匀.
c.用0.2000 mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式 ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 ;
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”) ;若本次滴定消耗碘的标准溶液为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为 (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com