
����Ŀ����ͭ��(��Ҫ�ɷ�ΪCuFeS2)������ͭ�����������ԭ�ϡ��ش���������:
��1����̬Cuԭ�ӵļ۵����Ų�ʽΪ________
��2����ԭ�ӽṹ�Ƕȷ���,��һ������I1(Fe)��I1(Cu)�Ĺ�ϵ��:I1(Fe)____I1(Cu)(�>��<"��=��)
��3��Ѫ����������(C4H5N)����Ҫ�����Ѫ����(��Fe2+)����������ȱ����ƶѪ�����Ժ�Ѫ���صĽṹ����ͼ:
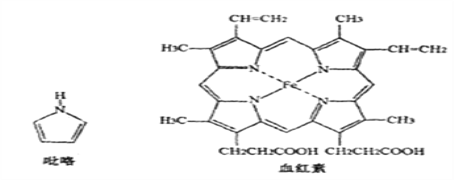
����֪�����еĸ���ԭ�Ӿ���ͬһƽ���ڣ�������������Nԭ�ӵ��ӻ�����Ϊ_______
��1mol���������������ĦҼ�����Ϊ____���������еĴ�м�����![]() ��ʾ������m���������γɴ�м���ԭ����,n���������γɴ�м��ĵ�����,�����Ի��еĴ�м�Ӧ��ʾΪ_____��
��ʾ������m���������γɴ�м���ԭ����,n���������γɴ�м��ĵ�����,�����Ի��еĴ�м�Ӧ��ʾΪ_____��
��C��N��O����Ԫ�صļ��⻯���У��е��ɵ͵��ߵ�˳��Ϊ________(�ѧʽ)��
��ѪҺ�е�O2����Ѫ�������������γɵ�Ѫ�쵰�������͵�,��Ѫ�쵰���е�Fe2+��O2��ͨ��_____�����ϡ�
��4����ͭ��ұ��ͭʱ������SO2�ɾ���SO2![]() SO3
SO3![]() H2SO4;���γ����ꡣSO2�Ŀռ乹 ��Ϊ________��H2SO4������ǿ��H2SO3��ԭ����____________
H2SO4;���γ����ꡣSO2�Ŀռ乹 ��Ϊ________��H2SO4������ǿ��H2SO3��ԭ����____________
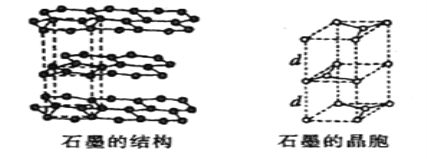
��5����ʯī���缫������ͭ����Ƶ�����ͭ��Һ�͵�����ʯī�ľ���ṹ����ͼ��ʾ,���߹��ճ������侧������ʯī�����к�̼ԭ����Ϊ____������֪ʯī���ܶ�Ϊ��g/cm3,C-C���ļ���Ϊrcm,�谢���ӵ�������ֵΪNA,��ʯī����IJ���d=______cm��
���𰸡� 3d104s1 �� sp2 10NA ![]() CH4��NH3��H2O ��λ�� V�� SO2(OH)2(��H2SO4)��S�Ļ��ϼ�Ϊ+6��S��������ǿ��SO(OH)2����H2SO3���е�S��ʹ�ǻ���O��H��Ĺ��õ��ӶԸ���ƫ��Oԭ�ӣ��ǻ����������H+��������H2SO4ǿ��H2SO3 4
CH4��NH3��H2O ��λ�� V�� SO2(OH)2(��H2SO4)��S�Ļ��ϼ�Ϊ+6��S��������ǿ��SO(OH)2����H2SO3���е�S��ʹ�ǻ���O��H��Ĺ��õ��ӶԸ���ƫ��Oԭ�ӣ��ǻ����������H+��������H2SO4ǿ��H2SO3 4 ![]()
����������1��Cuԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d104s1����̬Cuԭ�ӵļ۵����Ų�ʽΪ.3d104s1 ����ȷ����.3d104s1��
2��Cuԭ�ӵļ۵���3d104s1��ʧȥ1�����Ӻ�3d10��Ϊȫ����״̬���ṹ�ȶ�������ͭԭ����ʧȥ1�����ӣ���һ�����ܽ�С������ԭ�Ӽ۵���Ϊ3d64s2��ʧȥ1�����Ӻ����ȶ��ṹ�����ԣ���ԭ�Ӳ���ʧȥ1�����ӣ���һ�����ܽϴ�����I1(Fe)>I1(Cu)����ȷ����>��
��3������֪�����еĵ�ԭ������������ԭ�Ӿ���ͬһƽ������Ϊƽ�������Σ�������������Nԭ�ӵ��ӻ�����Ϊsp2 ����ȷ����sp2��
�ڸ��ݷ��ӽṹ��֪1mol���������е�����Ϊ��������1��N-H������4��C-H������2��C-N������3��C-C������������������������Ϊ10 NA �����Ի��������γɴ�������ԭ����4��̼+1����=5����������Ϊ����ԭ����δ����ɼ��ĵ���Ϊ1�ԣ�̼̼ԭ�Ӽ�����γ������⣬����4��̼�ֱ��ṩ1�������γ����������е�����Ϊ6���������Ի��еĴ�����Ӧ��ʾΪ![]() ����ȷ�𰸣�10 NA ��
����ȷ�𰸣�10 NA �� ![]() ��
��
�����Ӽ���������е���ͣ���NH3��H2O�����о��������������ԭ�ӵĵ縺�Դ��뵪ԭ�����������H2O���Ӽ�ϴ�ˮ�ķе���ߣ�����������⻯��ķе��ɵ͵��ߵ�˳��ΪCH4��NH3��H2O����ȷ�𰸣�CH4��NH3��H2O��
��Fe2+�ṩ�չ����O2�ṩ�µ��Ӷ���ͨ����λ����������ȷ������λ����
��4��S��̬3s2 3p4��1��3s��2��3p����sp2�ӻ���SO2�Ŀռ乹��Ϊƽ����������SO2(OH)2(��H2SO4)��S�Ļ��ϼ�Ϊ+6��S��������ǿ��SO(OH)2����H2SO3���е�S��ʹ�ǻ���O��H��Ĺ��õ��ӶԸ���ƫ��Oԭ�ӣ��ǻ����������H+��������H2SO4ǿ��H2SO3 ����ȷ����ƽ����������SO2(OH)2(��H2SO4)��S�Ļ��ϼ�Ϊ+6��S��������ǿ��SO(OH)2����H2SO3���е�S��ʹ�ǻ���O��H��Ĺ��õ��ӶԸ���ƫ��Oԭ�ӣ��ǻ����������H+��������H2SO4ǿ��H2SO3 ��
��5��ʯī�ľ����ṹ��ͼ��ʾ���辧���ĵױ߳�Ϊacm����Ϊhcm������dcm����h=2d����ͼ���Կ���1��ʯī�����к���4��̼ԭ��(4=8��![]() +4��
+4��![]() +2��
+2��![]() +1)��
+1)��
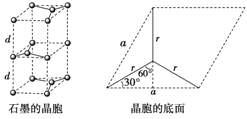
����ͼ��֪:a/2=r��sin 60�㣬��a=��3r��
��g��cm-3=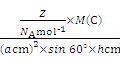 =
= �����d=
�����d=![]() ����ȷ����4��
����ȷ����4��![]() ��
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д� Ŀ�����ϵ�д�
Ŀ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
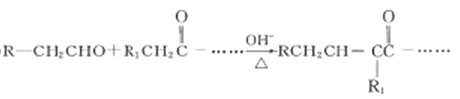
����Ŀ��������G��������Ѫ�ܼ�����ij��ҩ�����Ҫ�м��塣��ϩ��A��������DΪԭ�Ϻϳ�����·����ͼ��ʾ������D����Է�������Ϊ92��C�����к˴Ź�������ֻ��1���塣
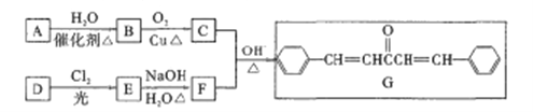
��֪����ͬһ��̼ԭ������2���ǻ�ʱ���Զ���ȥһ��ˮ���ӡ�
��
��1��A�ķ���ʽΪ______��B�Ľṹ��ʽΪ______�� G�й�����������________
��2��A��B�ķ�Ӧ������__��F������Ϊ________
��3��д��E��F�Ļ�ѧ����ʽ��____________
��4��E�ж���ͬ���칹�����������ڷ����廯����Ļ���______����д���˴Ź���������3��������ʵĽṹ��ʽ________
��5����ҵ������ȩΪԭ�Ϻϳ�CH3CH2CHClCOOH��·��ͼ������
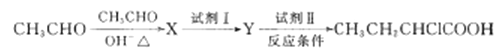
��д��X�Ľṹ��ʽ_______
���Լ�I��_____���Լ���Ӧ�����ֱ�_____�����ȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ���ǣ� ��
A. ������ԭ����Ϊ0.4NA��CH3OH�����к��еĹ��ۼ���ĿΪ0.5NA
B. a gij���庬������Ϊb��c g�������ڱ�״�������Ϊ![]() L
L
C. ��ⱥ��ʳ��ˮ����������22.4 L����ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. �����£�1.0 L pH��13��Ba(OH)2��Һ�к��е�OH����ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ�е�����Ũ�ȹ�ϵ��ȷ����
A. NH4C1��Һ����c(Cl-)=c(NH4+)>c(OH-)=c(H+)
B. Na2SO4��Һ����c(Na+) + c(H+)=c(SO42-) + c(OH-)
C. NaHCO3��Һ����c(Na+)> c(HCO3-) >c(CO32-)> c(OH-)
D. Ũ�Ⱦ�Ϊ0.1mol/LCH3COOH ��CH3COONa��Һ�������ϣ�c(CH3COO-) + c(CH3COOH)=0.1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�������300����70MPa���ɶ�����̼�������ϳ��Ҵ��ѳ�Ϊ��ʵ��2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ���������������
CH3CH2OH(g)+3H2O(g) ���������������
A. ʹ��Cu-Zn-Fe�����ɴ���������Ч��
B. ��Ӧ����300�����п��Ʋ�÷�Ӧ�����ȷ�Ӧ
C. �������CO2��������H2��ת����
D. ��ƽ���������з����CH3CH2OH��H2O�����CO2��H2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������˵����ȷ����
A.�ܶȱ�ˮ��B.�����ڼױ�
C.����������ԭ�Ӵ���ͬһƽ��D.��ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ͬŨ�ȵ�NaOH��Һ���ֱ�ζ�Ũ�Ⱦ�Ϊ0.1mol��L��1��������(HA��HB��HD)��Һ���ζ���������ͼ��ʾ�������жϴ������( )

A. ������ĵ��볣����ϵ��KHA��KHB��KHD
B. �ζ���P��ʱ����Һ�У�c(B��)��c(Na��)��c(HB)��c(H��)��c(OH��)
C. pH=7ʱ��������Һ�У�c(A��)=c(B��)=c(D��)
D. ���кͰٷ�����100%ʱ����������Һ��Ϻ�c(HA)��c(HB)��c(HD)=c(OH��)��c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǹ�ҵ����Ҫ�Ļ���ԭ�ϣ�Ҳ��ʵ�����ﳣ�����Լ���
�ⶨ�к��ȣ�
д��ϡ�����ϡ����������Һ��Ӧ��ʾ�к��ȵ��Ȼ�ѧ����ʽ__________________________
���к�����ֵΪ57.3kJ/mol����
��2��ȡ50mL 0.5mol/L HCl��Һ��50mL0.55mol/L NaOH��Һ���вⶨ����ʵ����ֵС��57.3kJ/mol��ԭ������_______________������ţ���
A�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�Ӳⶨ������¶�
B����ȡ��������ʱ���Ӷ���
C���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
D��ʵ��װ�ñ��¡�����Ч����
������к͵ζ���
���ⶨijNaOH��Һ�����ʵ���Ũ�ȣ�����0.1000 mol��L-1 HCl����Һ�����к͵ζ�(�÷�̪��ָʾ��)����ش��������⣺
��1������ѧ����ʵ������У���¼�ζ�ǰ�ζ�����Һ�����Ϊ1.10 mL���ζ���Һ����ͼ�����ʱ���ı���Һ�����Ϊ_________________��

��2����ѧ����������ƽ��ʵ�飬���ݼ�¼���£�
ʵ����� | ����NaOH��Һ�����/mL | 0.1000mol��L-1HCl��Һ�����/mL | |
�ζ�ǰ�̶� | �ζ���̶� | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
ѡȡ�����������ݣ����������NaOH��Һ�����ʵ���Ũ��Ϊ________________(С���������λ)��
��3��������Щ������ʹ�ⶨ���ƫ��___________(�����)��
A����ƿ������ˮϴ�������ô���Һ��ϴ
B����ʽ�ζ���������ˮϴ�������ñ�Һ��ϴ
C���ζ�ǰ��ʽ�ζ��ܼ������δ�ų����ζ���������ʧ
D���ζ�ǰ������ȷ���ζ����ӵζ��ܶ���
�ζ��յ���ж�__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25����101 kPa�£�1 g�״�ȼ������CO2��Һ̬ˮʱ����22.68 kJ,�����Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A. CH3OH��l��+![]() O2��g��===CO2��g��+2H2O��l������H=" +725.8" kJ/mol
O2��g��===CO2��g��+2H2O��l������H=" +725.8" kJ/mol
B. 2CH3OH��l��+3O2��g��===2CO2��g��+4H2O��l������H= ��1452 kJ/mol
C. 2CH3OH��l��+3O2��g��===2CO2��g��+4H2O��l������H= ��725.8 kJ/mol
D. 2CH3OH��l��+3O2��g��===2CO2��g��+4H2O��l������H=" +1452" kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com