
| ||
| ||


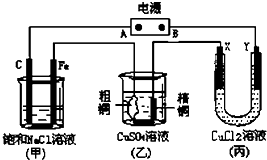
科目:高中化学 来源: 题型:
| A、其最高化合价为+3价 |
| B、可以形成化学式为KXO3的盐 |
| C、其氢化物可以用来做喷泉实验 |
| D、其最高价氧化物的水化物是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
| B、制取并用排水法收集氧气结束后,应立即停止加热 |
| C、浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
| D、浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
| B、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| C、硫代硫酸钠溶液中滴入稀盐酸:S2O32-+2H+═S↓+SO2↑+H2O |
| D、在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图:
对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| 时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com