
【题目】下列说法正确的是( )
A.氟利昂-12(CF2Cl2)是甲烷的氯、氟卤代物,它有2种同分异构体
B.对甲基苯甲醛(![]() )使高锰酸钾酸性溶液褪色,说明它含有醛基
)使高锰酸钾酸性溶液褪色,说明它含有醛基
C.溴水可以区分苯和乙酸
D.糖类是食物组成中的重要部分,也是产生能量最高的营养物质
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大。A原子是元素周期表中原子半径最小的原子;B可以与A形成常温下常见的液态物质;C原子的最外层电子数为比最内层电子数少1;D单质在空气中点燃发出耀眼的白光;E是第3周期非金属性最强的元素。
(1)A、B形成的具有强氧化性的18电子的物质的电子式为:___________
(2)C、D最高价氧化物的水化物的碱性__>__。(填化学式)
(3)B、C形成的简单离子半径大小__>__。(填具体离子符号)
(4)E的最高价氧化物的水化物与D的最高价氧化物的水化物在溶液中反应的离子方程式___________
(5)写出化合物CE的形成过程为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的选项正确的是
A.  配制0.10mol·L-1 NaOH溶液
配制0.10mol·L-1 NaOH溶液
B. 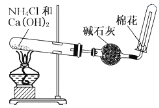 实验室制取干燥的氨气
实验室制取干燥的氨气
C.  萃取碘水中I2,分出水层后的操作
萃取碘水中I2,分出水层后的操作
D. 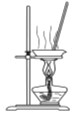 蒸干FeCl2溶液制取FeCl2·4H2O
蒸干FeCl2溶液制取FeCl2·4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“实验目的、结论”的对应关系中正确的是( )
操作和现象 | 实验目的或结论 | |
A | 将H2S气体通入CuSO4溶液中,产生黑色沉淀 | H2S的酸性比H2SO4的强 |
B | 固体溶解于水后的溶液中加入澄清的石灰水 | 探究家庭“食用碱”的成分是 碳酸钠还是碳酸氢钠 |
C | 某溶液先加稀硝酸,再加BaCl2溶液,产生白色沉淀 | 能证明该溶液中一定含有Ag+ |
D | 向MgCl2溶液(含FeCl3)中加入足量MgCO3粉末 | 除去MgCl2溶液中少量FeCl3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对可逆反应:2NO2(g) ![]() 2NO(g) +O2(g) ΔH=- 1162kJ·mol-1的影响,若保持气体的总质量不变,在温度为T1、T2时,通过实验得到平衡体系中 NO体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是( ):
2NO(g) +O2(g) ΔH=- 1162kJ·mol-1的影响,若保持气体的总质量不变,在温度为T1、T2时,通过实验得到平衡体系中 NO体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是( ):

A. a、c两点混合气体的平均相对分子质量:Ma>Mc
B. b、c两点的平衡常数:Kb=Kc
C. 从状态a到状态c,NO2气体的转化率减小
D. 状态a通过升高温度可变成状态b,a、b两点气体颜色:a深、b浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的5种短周期元素。A与D、C与E分别同主族,E原子的最外层电子数比次外层少2个。A、B两元素可形成BA3气体分子甲,甲能使湿润的红色石蕊试纸变蓝且每个分子内含10个电子。请回答下列问题:
(1)气体甲溶于水所得溶液呈碱性的原因(用电离方程式表示)______________。
已知:甲、乙、丙、丁4种物质之间的转化关系如下图(注:反应条件或产物已略去)。
甲![]() 乙
乙![]() 丙
丙![]() 丁
丁
请写出从甲→乙转化的化学方程式____________________________________________。
(2)用电子式表示离子化合物D2C2的形成过程____________________________________。
(3)DAEC3和DAEC4的溶液均呈现_______(填:“酸”“碱”“中”)性,在DAEB3溶液中离子浓度由大到小的顺序是________________________________;如果将两种溶液混合后发生反应的离子方程式为____________________________________。
(4)已知A2EC3和A2EC4两种酸中酸性更强的是后者,请从分子结构和性质的关系角度解释这种差异产生的原因___________________________________。
(5)B元素的三氯化物(BCl3)常温下是一种淡黄色液体,具有三角锥型的分子结构。下列关于BCl3分子的描述中不正确的是_________________。
A.BCl3分子中B显-3价、采用SP3杂化
B.BCl3分子间可形成氢键,比PCl3难挥发
C.B、C元素的电负性B< C ,第一电离能B>C
D.BCl3遇水发生水解反应产物是BH3和HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。

(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
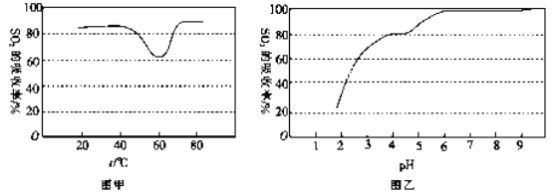
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
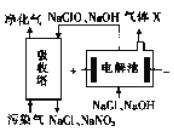
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某无色溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、AlO2-、CO32-、SO42-、I-、SiO32-,MnO4-中的N种离子组成。某化学兴趣小组通过下列实验确定了其组成:
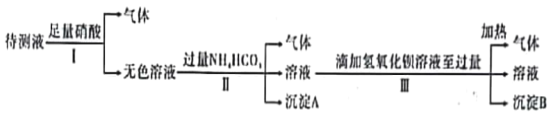
回答下列问题:
(1)不用做实验就可以肯定原溶液X中不存在的离子是_______________(填离子符号)。
(2)通过上述实验知,X溶液中一定存在__________种离子(填数字;不考虑H+、OH-)。
(3)在上述滴加氢氧化钡溶液过程中,开始阶段发生反应的离子方程式一定有_____________
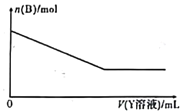
(4)该化学兴趣小组的同学为了进一步确定白色沉淀B的成分,取一定量经洗涤后的B与Y溶液反应,沉淀B的物质的量与Y溶液体积之间的关系如图所示。Y可能为____________。B的组成为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
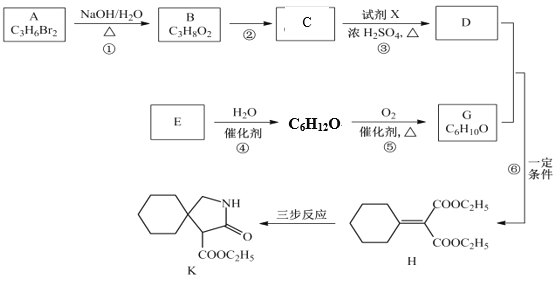
【题目】有机物K是某药物的前体,合成路线如图所示:
已知:R-CN ![]()
![]() ;
;
![]()
![]() +
+![]()
(1)B的结构简式是_____________。
(2)反应③的化学方程式是__________________。
(3)E属于烃,其分子式是_________________。
(4)H中含氧官能团的名称是_________________。
(5)写出满足下列条件的 K的一种同分异构体的结构简式:________________________
①遇氯化铁溶液显紫色; ②不含醚键; ③核磁共振氢谱显示峰面积之比为2:12:2:2:1
(6)H经三步反应合成K,写出J→K的化学方程式_____________________________。
![]() .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com