
| A、Na2O2晶体中阴阳离子个数比2:1 |
| B、0.2mol?L-1的CH3COOH溶液与0.1mol?L-1CH3COOH溶液中c(H+)之比 |
| C、pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 |
| D、pH=11的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
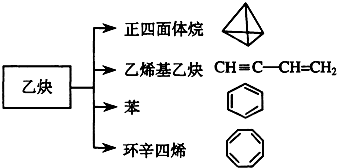
| A、正四面体烷的二氯取代产物有2种 |
| B、正四面体烷与乙烯基乙炔互为同分异构体 |
| C、苯与环辛四烯互为同系物 |
| D、等质量的苯与环辛四烯完全燃烧消耗氧气量不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| B、c(HCO3-)>c(ClO-)>c(OH-) |
| C、c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、SiO32-、Cl-、NO3- |
| B、H+、NH4+、Al3+、SO42- |
| C、Na+、S2-、OH-、SO42- |
| D、Na+、C6H5O-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl溶液 |
| B、NaOH溶液 |
| C、KCl溶液 |
| D、KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 |
| B、加入0.1mol/L 的醋酸溶液100mL |
| C、加入少量的0.5mol/L的硫酸 |
| D、加入少量1mol/L 的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁达尔现象可用来区别胶体与溶液 |
| B、胶体粒子能通过半透膜,不能通过滤纸 |
| C、胶体不稳定,在一定条件下会发生聚沉 |
| D、溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com