
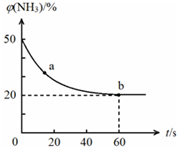
 合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%.
合理应用和处理氮的化合物,在生产生活中有重要意义.密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?CO(NH2)2 (s)+H2O(g),混合气体中NH3的物质的量分数[ϕ(NH3)]随时间变化关系如图所示.则a点的正反应速率υ正(CO2)>b点的逆反应速率υ逆(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是75%. 分析 图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率.
解答 解:氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2+2NH3?(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x 0.5x
氨气的体积分数=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%;解得x=37.5mol,
氨气的平衡转化率=$\frac{37.5mol}{50mol}$×100%=75%,
故答案为:>;75%.
点评 本题考查化学平衡的移动及平衡的计算,为高频考点,侧重于学生的分析、计算能力的考查,题目难度大,熟悉平衡原理是解题关键.


科目:高中化学 来源: 题型:选择题
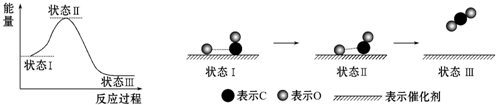
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO和O反应生成CO2的过程 | |
| D. | 状态Ⅰ→状态Ⅲ表示CO与O2反应生成CO2的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量 M=$\frac{22.4mw}{[(1-w)V]}$ | B. | 物质的量浓度 c=$\frac{1000dV}{(MV+22.4m)}$ | ||
| C. | 溶质的质量分数 w=$\frac{MV}{22.4m}$ | D. | 溶液密度 d=$\frac{cM}{1000w}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 微粒浓度关系:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
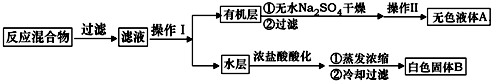
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
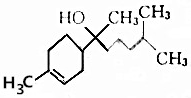
| A. | 分子式为C15H26O | B. | 能和NaHCO3溶液反应生成CO2 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能与乙酸发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com