

 ,A的二氯取代物有1种.
,A的二氯取代物有1种.分析 根据球棍模型可知,A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷.
(1)D为乙炔,甲烷是正四面体;
(2)乙烯是植物生长调节剂;(3)甲烷与氯气发生取代反应生成一氯甲烷和氯化氢;
(4)乙烯中含有碳碳双键,一定条件下,乙烯和水发生加成反应生成乙醇.
解答 解:(1)D的化学式为C2H2,电子式: ,甲烷是正四面体,二氯取代物1种,故答案为:
,甲烷是正四面体,二氯取代物1种,故答案为: ;1;
;1;
(2)乙烯有催熟作用,是植物生长调节剂,结构简式:CH2=CH2,故答案为:CH2=CH2;
(3)甲烷和氯气在光照条件下发生取代反应生成一氯甲烷和氯化氢,反应的方程式为:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl,故答案为:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl;
(4)乙烯中含有碳碳双键,在一定条件下,乙烯和水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
点评 本题考查了有机物结构与性质、球棍模型的表示方法,题目难度中等,注意掌握常见有机物结构与性质,明确球棍模型表示的意义是解答本题关键.


科目:高中化学 来源: 题型:解答题
| 不纯物 | 除杂试剂 | 分离方法 |
| 乙烷(乙烯) | ||
| 苯(苯酚) | ||
| 乙醇(水) |
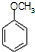 .
.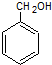 .
.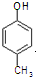 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| B. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| C. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 | |
| D. | 聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
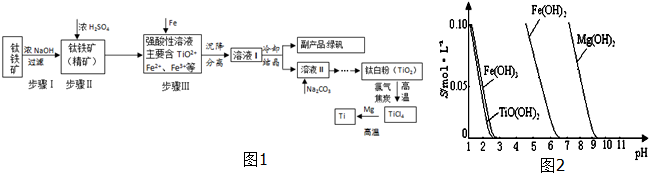
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com