
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如图:
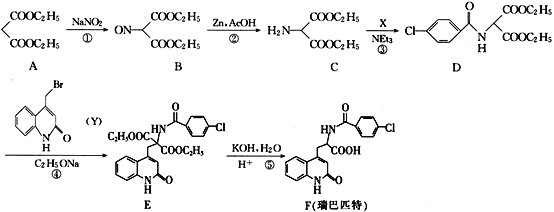
(1)A的化学名称为__,A与足量的NaOH溶液反应的化学方程式__。
(2)化合物D中含氧官能团的名称为__。
(3)反应①~④中,属于取代反应的是__(填序号)。
(4)C→D的转化中,生成的另一种产物为HCl,则X的结构简式为__。
(5)已知Y中的溴原子被-OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:__。
Ⅰ.分子中含有一个苯环和一个五元环,且都是碳原子形成环;
Ⅱ.苯环上的一氯代物只有两种;
Ⅲ.能与NaHCO3溶液发生反应。
(6)已知:CH3CH2OH![]() CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,请写出以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图___(无机试剂任用)。
的合成路线流程图___(无机试剂任用)。
【答案】丙二酸二乙酯 C2H5OOCCH2COOC2H5+2NaOH![]() NaOOCCH2COONa+2C2H5OH 肽键、酯基 ①③④
NaOOCCH2COONa+2C2H5OH 肽键、酯基 ①③④ ![]()
![]() (或其它合理答案)
(或其它合理答案) 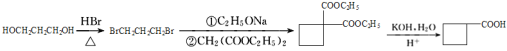
【解析】
分析瑞巴匹特合成路线:A与NaNO2反应,中间—CH2—的1个H被—NO取代得到B,B在Zn、AcOH作用下—NO被还原为—NH2得到C,C与X反应,C中—NH2上的1个H被![]() 取代得到D,反应④中D分子中与N相连的C上的H被
取代得到D,反应④中D分子中与N相连的C上的H被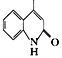 取代得到E,E经KOH、H2O处理后酸化得到目标产物F瑞巴匹特。可在此基础上解各小题。
取代得到E,E经KOH、H2O处理后酸化得到目标产物F瑞巴匹特。可在此基础上解各小题。
(1)A为丙二酸的二乙醇酯,化学名称为:丙二酸二乙酯;A为二元酯,与足量的NaOH溶液反应的化学方程式为:C2H5OOCCH2COOC2H5+2NaOH![]() NaOOCCH2COONa+2C2H5OH;
NaOOCCH2COONa+2C2H5OH;
答案为:丙二酸二乙酯;C2H5OOCCH2COOC2H5+2NaOH![]() NaOOCCH2COONa+2C2H5OH;
NaOOCCH2COONa+2C2H5OH;
(2)化合物D含氧官能团有![]() 、
、![]() ,名称分别为:肽键、酯基。
,名称分别为:肽键、酯基。
答案为:肽键、酯基;
(3)根据分析可知,反应①~④中,属于取代反应的是①:A分子中1个—CH2—的1个H被—NO取代,③:C中—NH2上的1个H被![]() 取代,④:D分子中与N相连的C上的H被
取代,④:D分子中与N相连的C上的H被 取代。
取代。
答案为:①③④;
(4)C→D的转化中,C与X反应,C中—NH2上的1个H被![]() 取代得到D,生成的另一种产物为HCl,则X为
取代得到D,生成的另一种产物为HCl,则X为![]() 和Cl相连的有机物,结构简式为
和Cl相连的有机物,结构简式为![]() 。
。
答案为:![]() ;
;
(5Y中的溴原子被-OH取代所得Z的结构简式为: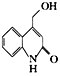 ,分子式为C10H9NO2。
,分子式为C10H9NO2。
由条件Ⅲ.能与NaHCO3溶液发生反应,可判断Z含1个-COOH;由条件Ⅰ.分子中含有一个苯环和一个五元环,且都是碳原子形成环,可判断Z可能有结构:![]() 或
或 等;根据条件Ⅱ.苯环上的一氯代物只有两种,可判断苯环上应有2个取代基,一个为-COOH,另一个应为-NH2。据此可写出符合条件的Z的同分异构体为:
等;根据条件Ⅱ.苯环上的一氯代物只有两种,可判断苯环上应有2个取代基,一个为-COOH,另一个应为-NH2。据此可写出符合条件的Z的同分异构体为:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等。
等。
答案为:![]() (或其它合理答案);
(或其它合理答案);
(6)参照瑞巴匹特合成路线中的步骤④、⑤,![]() 可由
可由![]() 经KOH、H2O处理后酸化而来,
经KOH、H2O处理后酸化而来,![]() 可由BrCH2CH2CH2Br与
可由BrCH2CH2CH2Br与![]() 发生取代反应而来,BrCH2CH2CH2Br可由HOCH2CH2CH2OH与HBr发生取代反应而来。所以,以A和HOCH2CH2CH2OH为原料制备
发生取代反应而来,BrCH2CH2CH2Br可由HOCH2CH2CH2OH与HBr发生取代反应而来。所以,以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图可设计为:
的合成路线流程图可设计为: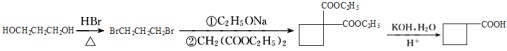 。
。
答案为: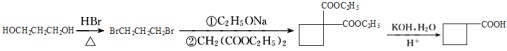 。
。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2。在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_____。
(2)500℃该反应的平衡常数为_____(结果保留一位小数)。
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)____v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业废气和汽车尾气中含有多种氮氧化物,主要是NO 和NO2,都以NOx来表示。NOx能破坏臭氧层,产生光化学烟雾,是造成大气污染的主要来源之一。回答下列问题:
(1)已知 1mol 分子分解为单个原子所需要的能量为解离焓。 N2(g)、NO(g)、O2(g)的解离焓分别为941.7、631.8、493.7(单位kJ/mol),计算反应 2NO(g) = N2(g) + O2(g)的△H=_______kJ/mol,试判断NO(g)常温、常压下能否自发分解 ________填能或不能)。
(2)为防止光化学烟雾,除从工厂、汽车的设计进行改进外,也要采用某些化学方法。用焦炭还原NOx 的反应为2NOx(g) + xC(s)N2(g) + xCO2(g)
Ⅰ.在恒温条件下,2 molNO2(g)和足量 C(s)反应,测得平衡时 NO2(g)和 CO2(g)的物质的量浓度与平衡总压的关系如图所示:
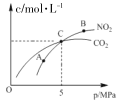
①A、B两点NO2平衡转化率的关系α(A)____α(B),平衡常数关系K(A)_____K(B)(填>、<或=)。
②计算C点时该反应的压强平衡常数Kp=_____MPa(Kp是用平衡分压代替平衡浓度)计算,分压=总压×物质的量分数)。
Ⅱ.现在向容积均为 2L 的两个密闭容器A、B中加入一定量的 NO(g)和足量的C(s),相同温度下测得两容器中n(NO)随时间变化情况如表所示:
0 | 20 | 40 | 60 | 80 | |
n(NO)/mol(A) | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
n(NO)/mol(B) | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
B容器内反应在 100s时达到平衡状态,则0~100s内用 NO 表示的平均反应速率为v(NO)= ____________。
(3)近年来电化学方法在处理氮氧化物方面也起到了一定的作用,如图是一种氨气一二氧化氮燃料电池,常温下可将二氧化氮转化为氮气。

①c口通入的气体为______ ,写出负极反应的方程式 ________。
②若a、d口产生的气体体积共为1.568L(标况下),电路中通过的电子数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 化学平衡正向发生移动时,平衡常数K值一定增大
B. HS-的电离方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. 由水电离出的c(H+)=1×10-13mol/L的溶液中,可能大量共存的离子:Fe3+、K+、NH4+、 SO42-、Cl-、ClO-
D. AlCl3溶液与Na2CO3溶液混合发生反应:2Al3++3CO32-=Al2(CO3)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离于方程式书写正确的是
A. 加热CuSO4溶液:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
B. 泡沫灭火器工作时的化学反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2+H2↑+OH-
Cl2+H2↑+OH-
D. 向NH4HCO3溶液中加入过量的NaOH(溶液)加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是
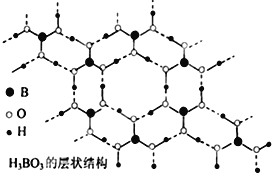
A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:2Zn(s) + O2(g) =2ZnO(s) ΔH1=-702.2kJ/mol
Hg(l) + ![]() O2(g) =HgO(s) ΔH2=-90.7kJ/mol
O2(g) =HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3 ,其中ΔH3的值是( )
A. -260.4 kJ/mol B. -254.6 kJ/mol
C. -438.9 kJ/mol D. -441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各组物质中,互为同位素的是_____(填序号,下同),互为同系物的是_____,互为同分异构体的是_____。
①红磷与白磷 ②35Cl与37Cl ③CH3COOCH3与CH3CH2COOCH3④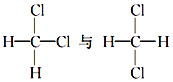 ⑤
⑤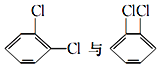 ⑥
⑥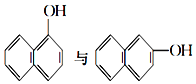 ⑦乙醇与二甲醚
⑦乙醇与二甲醚
(2)按系统命名法给下列有机物命名:
①CH3CH(C2H5)CH(CH3)2:_____。
②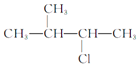 _____
_____
③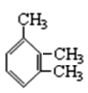 _____
_____
(3)写出下列有机反应的方程式:
①1,3-丁二烯的加聚反应:_____
②3-甲基-2-丁醇的催化氧化反应:_____
③甲醛与新制氢氧化铜反应:_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.T℃时,pH=7的溶液一定呈中性
B.已知反应2NO2(g)![]() N2O4(g)在低温下可自发进行,则△H>0
N2O4(g)在低温下可自发进行,则△H>0
C.在0.1molL-1的NH4Cl溶液中:c(NH4+)+c(NH3H2O)=0.1molL-1
D.在Na2CO3溶液中:c(Na+)=2c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com