
【题目】化合物Q是一种治疗心脏病药物的中间体,其以苯酚为原料的工业合成路线如图所示。
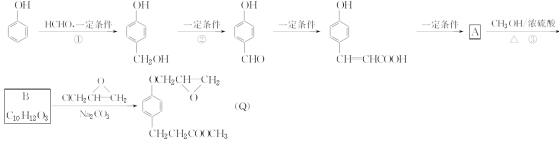
已知:RONa+R′X―→ROR′+NaX
(1)A的分子式为________,B的结构简式为____________________________。
(2)①的化学方程式为__________________________________________。
(3)关于有机物B的说法中,正确的是________。
A.分子中至少有7个碳原子共平面
B.1 mol该有机物与足量NaOH溶液反应,会消耗2 mol NaOH
C.该有机物能发生取代反应、加成反应和氧化反应
D.完全燃烧1 mol该有机物消耗257.6 L氧气
(4)有机物![]() 的含氧官能团的名称为_____,核磁共振氢谱图上共有___个峰,请写出两种满足下列要求的该有机物的同分异构体的结构简式:______。
的含氧官能团的名称为_____,核磁共振氢谱图上共有___个峰,请写出两种满足下列要求的该有机物的同分异构体的结构简式:______。
①能发生银镜反应; ②苯环上有三个互为间位的取代基;
③苯环上一元取代物只有两种同分异构体; ④能与金属钠发生反应。
【答案】C9H10O3![]()
 ABC酚羟基、羧基6
ABC酚羟基、羧基6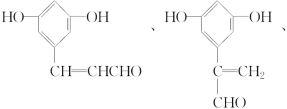
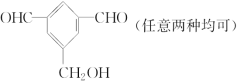
【解析】
(1)由有机合成路线可知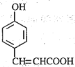 与氢气发生加成反应生成A,A与甲醇发生酯化反应生成B,故答案为:C9H10O3、
与氢气发生加成反应生成A,A与甲醇发生酯化反应生成B,故答案为:C9H10O3、![]() ;(2)①为苯酚与甲醛的加成反应,其方程式为:
;(2)①为苯酚与甲醛的加成反应,其方程式为:![]() ;(3)B的结构简式为:
;(3)B的结构简式为: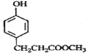 ,由苯环的平面结构可知分子中至少有7个碳原子共面,故A说法正确;由分子中含有酚羟基和酯基可知1molB可与2molNaOH反应,故B说法正确;由分子中的酚羟基、苯基和酯基可知该有机物能发生取代反应、加成反应和氧化反应,故C说法正确;D中消耗的氧气的体积没有说明所处的状态,故D说法错误;答案为:ABC;(4)
,由苯环的平面结构可知分子中至少有7个碳原子共面,故A说法正确;由分子中含有酚羟基和酯基可知1molB可与2molNaOH反应,故B说法正确;由分子中的酚羟基、苯基和酯基可知该有机物能发生取代反应、加成反应和氧化反应,故C说法正确;D中消耗的氧气的体积没有说明所处的状态,故D说法错误;答案为:ABC;(4)![]() 中的含氧官能团为羟基和羧基,由结构的对称性可知分子中有6种不同的氢原子,故核磁共振氢谱图上共有6个峰,其同分异构体①能发生银镜反应和④能与金属钠发生反应说明分子结构中含有醛基和羟基,另由其结构②苯环上有三个互为间位的取代基和③苯环上一元取代物只有两种同分异构体可得其结构简式可能为:
中的含氧官能团为羟基和羧基,由结构的对称性可知分子中有6种不同的氢原子,故核磁共振氢谱图上共有6个峰,其同分异构体①能发生银镜反应和④能与金属钠发生反应说明分子结构中含有醛基和羟基,另由其结构②苯环上有三个互为间位的取代基和③苯环上一元取代物只有两种同分异构体可得其结构简式可能为: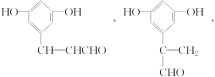 ,故答案为:酚羟基、羧基;6、
,故答案为:酚羟基、羧基;6、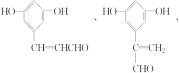 。
。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确是
A. 酸性HClO4>H3PO4,是因为HClO4分子非羟基氧原子数目比H3PO4多
B. 分子晶体中都存在共价键;晶体中只要有阳离子就一定有阴离子
C. HF稳定性很强,是因为分子间能形成氢键
D. 乳酸[CH3CH(OH)COOH]分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和生铁(铁合金)都是生活中常见的材料,下列说法中正确的是( )
A.铁与盐酸反应,生铁不与盐酸反应B.铁和生铁都是金属单质
C.铁和生铁都能导电,都是电解质D.生铁的熔点比铁的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有四种有机物:
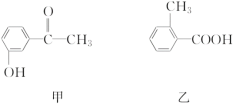

(1)请写出丙中含氧官能团的名称:____________;
(2)请判断上述哪些化合物互为同分异构体:______________________________;
(3)请分别写出鉴别甲、丙化合物的方法(指明所选试剂及主要现象即可)。
鉴别甲的方法:_____________________________________________________________;
鉴别丙的方法:_____________________________________________________________;
(4)相同条件下,甲、乙的酸性大小为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。下列关于CaF2的表述不正确的是
A. CaF2晶体中Ca2+与F-的配位数之比为2:1
B. F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
C. 阴阳离子比为2:1的物质,均与CaF2晶体构型相同
D. CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知:氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。活泼金属硫化物与酸反应产生H2S气体。
Ⅰ、制备氢化锂:选择下图中的装置制备氢化锂(有些装置可重复使用):

(1)装置的连接顺序(从左至右)为A→___________________________________。
(2)检查好装置的气密性,打开装置A中分液漏斗的活塞后,点燃酒精灯前需进行的实验操作是________。
Ⅱ、制备氢化铝锂
1947年,Schlesinger、Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅拌,充分反应后,经一系列操作得到LiAlH4晶体。
(3)写出氢化锂与无水三氯化铝反应的化学方程式_________________________。
Ⅲ.测定氢化铝锂产品(不含氢化锂)的纯度
(4)按下图连接好装置后,检查装置气密性的操作是:_____________________。装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是__________________。

(5)在标准状况下,反应前量气管(由碱式滴定管改装而成)读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为_________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将_________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)可作硫化剂、氯化剂。常温下是一种黄红色液体,沸点137°C,在空气中剧烈水解而发烟。S2Cl2可通过硫与少量氯气在110~140°C反应制得,氯气过量则会生成SCl2。
(1)选用以下装置制取少量S2Cl2(加热及夹持装置略):

①A中发生反应的化学方程式为_________________________。
②装置连接顺序:A→_____→______→______→______。
③B中玻璃纤维的作用是________________________________。
④D中的最佳试剂是_______(选填序号)。
a.碱石灰 b.浓硫酸
c.NaOH溶液 d.无水氯化钙
(2)S2Cl2遇水剧烈水解,生成SO2、HCl和一种常见的固体。
①该反应化学方程式为_________________________。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH溶液,乙同学认为该方案不可行,原因是______________________。
(3)乙同学按如下实验方案检验S2Cl2是否含有杂质:
①取1. 25g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO3)2溶液,过滤;
②往①的滤液中加入足量AgNO3溶液,过滤、洗涤、干燥,称得固体质量为2.87g。由此可知产品中________(填“含有”或“不含有”)SCl2杂质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com