
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2Cl2 | -76 | 138 | 1.75 | 与水反应 |
| CS2 | -109 | 47 | 1.26 | 不溶于水 |
| CCl4 | -23 | 77 | 1.59 | 不溶于水 |
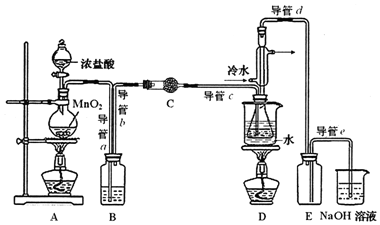
分析 制取原理是:显示二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混有HCl和水,应该先用饱和食盐水除去HCl,再用无水CaCl2(或P2O5)干燥氯气,让氯气和二硫化碳在一定温度下发生反应:CS2+3C12$\stackrel{95℃~100℃}{→}$CCl4+S2C12,为了使CS2平稳汽化,避免产物S2Cl2汽化,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可,实验中用E装置作安全瓶,可以防倒吸,氯气要进行尾气处理,可以用氢氧化钠来吸收,据此答题.
解答 解:(1)该实验结束时先熄灭装置D中酒精灯,再熄灭装置A中酒精灯;
故答案为:⑥;②;
(2)根据上面的分析可知,为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下;
故答案为:控制分液漏斗下端的活塞,使浓盐酸匀速滴下;
(3)装置C中盛有的试剂是无水CaCl2(或P2O5)干燥氯气,装置B中试剂为 饱和食盐水,吸收氯气中的氯化氢气体;
故答案为:无水CaCl2(或P2O5);饱和食盐水;
(4)装置D中冷凝管的作用是导气、冷凝回流,E装置作安全瓶,可以防倒吸;
故答案为:导气、冷凝回流;防倒吸;
(5)实验过程中,若缺少C装置,则装置中有水,S2Cl2会发生水解,产品中有硫产生而浑浊不清,并产生2种酸性气体为二氧化硫和氯化氢,其反应的化学方程式为2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑,
故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
点评 本题考查了物质的制备,杂质气体除杂的装置选择和试剂选择,题干信息的应用分析,化学方程式书写方法,混合物分离的方法判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| Ⅰ | 25 | 5 | 0.2 | 10 | 0.1 | x |
| Ⅱ | 25 | 10 | 0.1 | 10 | 0.2 | 5 |
| Ⅲ | 35 | 10 | 0.1 | 5 | y | 10 |
| A. | 该反应所需的仪器有:量筒、温度计、秒表、烧杯 | |
| B. | 通过记录产生淡黄色沉淀所需的时间可以比较反应的快慢 | |
| C. | 比实验 II、III研究温度对该反应速率的影响,则y=0.2 | |
| D. | 对比实验 I、II研究C(H+)对该反应速率的影响,则x=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 | |
| B. | 最高价氧化物对应水化物的碱性:Z<M | |
| C. | 气态氢化物的稳定性:R>Q | |
| D. | 简单离子的半径:X>Z>M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | FeS | MnS | HgS |
| 溶度积 | 5.0×l0-18 | 4.6×l0-14 | 2.2×l0-54 |
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2、Br2、Cl2 | B. | Na+、K+、Cs+ | C. | Cl-、Br-、I- | D. | Al3+、Mg2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2;△H3<△H4 | B. | △H1>△H2;△H3>△H4 | C. | △H1=△H2;△H3<△H4 | D. | △H1<△H2;△H3>△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=12的溶液中,Al3+、Cl-、HCO3-、Na+可以大量共存 | |
| B. | 在pH=0的溶液中,Na+、NO3-、SO32-、K+可以大量共存 | |
| C. | 由0.1 mol/L-元碱BOH溶液的pH=10,可推知BOH溶液存在BOH?B++OH- | |
| D. | pH=2的一元酸和pH=12的一元强碱等体积混后溶液一定存在:c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com