
【题目】请将符合题意的下列变化的序号填在对应的横线上:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。
(1)化学键没有被破坏的是__________;仅发生离子键破坏的是________;
(2)既发生离子键破坏、又发生共价键破坏的是______________;
(3)N2的电子式为________;Na2O2的电子式为________;
(4)用电子式表示MgCl2的形成过程 _____________
【答案】①② ③④ ⑥ ![]()
![]()
![]()
【解析】
①碘的升华属于物理变化,只是状态发生变化,只破坏分子间作用力,没有化学键的破坏;
②氧气溶于水,只破坏分子间作用力,化学键不变;
③氯化钠溶于水,在水分子的作用下,氯化钠中的离子键被破坏,所以破坏的是离子键;
④烧碱熔化中存在离子键,融化烧碱时,阴阳离子间的化学键被破坏,所以破坏的是离子键;
⑤氯化氢溶于水,在水分子的作用下,氯化氢中的共价键被破坏,所以破坏的是共价键;
⑥氯化铵受热分解,氯化铵是离子化合物,存在的化学键有离子键、共价键,受热分解时,阴阳离子间的化学键、及铵根离子中的共价键被破坏,所以所以破坏的是离子键、共价键。
(1)化学键没有被破坏的是①②,仅发生离子键破坏的是③④,故答案为:①②;③④。
(2)既发生离子键又发生共价键破坏的是⑥,故答案为:⑥。
(3)氮气中存在氮氮三键,氮气的电子式为![]() ,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为![]() ,故答案为:
,故答案为:![]() ,
,![]() 。
。
(4)MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为:![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列各组离子能在强酸性溶液中大量共存的是( )
A.K+、Na+、SO42-、NO3-B.OH-、Na+、Cl-、SO42-
C.Ba2+、K+、Cl-、SO42-D.K+、NH4+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 所有铵盐受热均可以分解,产物均有NH3
B. 所有铵盐都易溶于水,所有铵盐中的N均呈-3价
C. NH4Cl溶液中加入NaOH浓溶液共热时反应的离子方程式为NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. NH4Cl和NaCl的固体混合物可用升华法分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g 46%的乙醇溶液中,含H-O键的数目为NA
B. 1molNaHSO4在熔融状态下电离出的阳离子数为2NA
C. 氢氧燃料电池负极消耗1.12L气体时,电路中转移的电子数为0.1NA
D. 常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 化学键的断裂和化学反应中能量变化的根本原因
B. 凡吸热反应均需在加热条件下才能发生
C. 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D. 因为石墨变成金刚石吸热,所以金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到实验目的的是:
A. 用通入氧气点燃的方法除去CO2中的CO杂质
B. 用澄清石灰水鉴别NaHCO3和Na2CO3
C. 用激光笔照射可区分氡氧化铁胶体与氯化铁溶液
D. 用排水集气法收集二氧化氮气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是( )
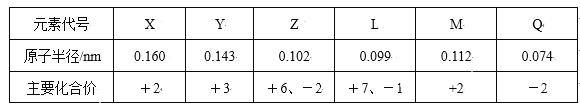
A. 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多
B. Y与Q形成的化合物不可能跟氢氧化钠溶液反应
C. Z的氢化物的稳定性强于L的氢化物的稳定性
D. 与稀盐酸反应的剧烈程度:M单质<X单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一碳化学”是指以含一个碳原子的化合物(如:CO2、CO、CH4、CH3OH等)为初始反应物,合成一系列重要的化工原料和燃料的化学。以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1=-159.47kJ/mol K1
NH2COONH4(s) △H1=-159.47kJ/mol K1
反应II:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol K2
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3 K3
CO(NH2)2(s)+H2O(g) △H3 K3
请回答下列问题:
(1)①总反应的△H3=_______kJ/mol。该热化学方程式的平衡常数K3=____________(用K1、K2表示)。
②反应I一般在_________(填“高温”或“低温”)情况下有利于该反应的进行。
③一定温度下,在体积为固定的密闭容器中按计量比进行反应I,下列不能说明反应达到了平衡状态的是__________(填序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.2V正(NH3)=V逆(CO2)
D.容器内混合气体的密度不再变化
④环境为真空时,在一敞开容器(非密闭容器)中加入NH2COONH4固体,足够长时间后,反应是否建立平衡状态? ___________(填“是”或“否”)。
(2)在体积可变的恒压(p总)密闭容器中充入1 mol CO2 与足量的碳,让其发生反应:C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。

①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“=”);若充入等体积的CO2 和CO,平衡________移动(填“正向”“逆向”或“不”)。
②650℃,CO2 的转化率为_____________。
③已知:气体分压(P分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡常数,925℃时,Kp=_____________ (用含P总的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化工生产过程中所发生的反应不属于氧化还原反应的是( )
A. 用大理石制生石灰B. 用铝土矿(Al2O3)制金属铝
C. 用氯气和消石灰制漂白粉D. CO与Fe2O3反应炼铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com