
| A. | 若5.6LN2中含有n个氮分子,则阿伏加德罗常数一定为4n | |
| B. | 4.6gNa与100 mL含0.1mol HCl的盐酸溶液反应,转移电子数目为0.2NA | |
| C. | 14g乙烯和丙烯的混合气体中所含分子总数为0.5NA | |
| D. | 标准状况下,22.4LCCl4含有的分子总数为NA |
分析 A.没有告诉标况下,不能使用标况下的气体摩尔体积计算氮气的物质的量;
B.钠为活泼的+1价金属,在溶液中完全反应;
C.乙烯和丙烯的摩尔质量不同,无法计算混合物的物质的量;
D.标准状况下,四氯化碳的状态为液体,不能使用标况下的气体摩尔体积计算.
解答 解:A.不是标况下,不能使用标况下的气体摩尔体积计算5.6L氮气的物质的量,故A错误;
B.4.6g钠的物质的量为:$\frac{4.6g}{23g/mol}$=0.2mol,钠为活泼金属,能够与水反应,所以0.2mol钠完全反应失去0.2mol电子,转移电子数目为0.2NA,故B正确;
C.乙烯和丙烯的摩尔质量不同,无法计算14g混合物的物质的量,故C错误;
D.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算22.4L四氯化碳的物质的量,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
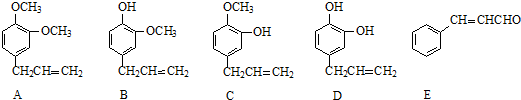
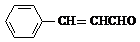 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$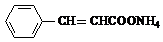 +H2O+2Ag↓+3NH3,Y的结构简式为
+H2O+2Ag↓+3NH3,Y的结构简式为 ,反应③属于加成反应.
,反应③属于加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量 | B. | 原子的核内中子数 | ||
| C. | 原子的次外层电子数 | D. | 原子的电子层数和最外层电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:b>a>c>d | B. | 原子半径:A>B>C>D | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 31g白磷中含有的共价键数目为1.5NA | |
| B. | 0.1L3.0mol•L-1的NH4N03溶液中含有的NH4+的数目为0.3NA | |
| C. | 标准状况下,22.4L己烷中含共价键数目为19NA | |
| D. | 常温常压下,lmolCl2与足量的水充分反应,转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 将磁性氧化铁溶于HI溶液:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| B | 明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-═2BaSO4↓+Al(OH)3↓ |
| C | 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O═2HCO3-+SO32- |
| D | NH4HCO3溶液中滴入过量的NaOH溶液:HCO3-+OH-═CO32-+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | … | … |
| CH4 | C2H6 | C5H12 | C8H18 | … | … | … |
| A. | C14H30 | B. | C17H36 | C. | C22H42 | D. | C26H54 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com