
下列有关电化学原理的说法中,错误的是
A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大
B.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极
C.氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气
D.可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016届福建省闽粤联合体高三上学期第三次联考化学试卷(解析版) 题型:选择题
下列各组物质的分类正确的是
①同位素:1H、2H2、3H ②同素异形体:C80、金刚石、石墨
③酸性氧化物:CO2、NO、SO3 ④混合物:水玻璃、水银、水煤气
⑤电解质:明矾、冰醋酸、石膏 ⑥干冰、液氯、乙醇都是非电解质
A.②⑤ B.②⑤⑥ C.②④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期月考化学试卷(解析版) 题型:填空题
水是最常用的溶剂,许多化学反应都需要在水溶液中进行。请仔细分析并回答下列各题。
(1)用0.1mol/LNaOH溶液滴定体积均为20.00mL、浓度均为0.1mol/L盐酸和醋酸溶液,得到如下所示滴定曲线图:
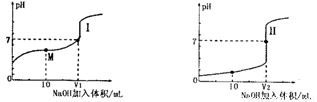
①用NaOH 溶液滴定醋酸溶液通常所选择的指示剂为________,符合其滴定曲线的是_______(填“I”或“II”);
②滴定前的上述三种溶液中,由水电离出的c(H+)最大的是_________溶液(填化学式);
③图中v1和v2大小的比较:v1_______v2 (填“>”、“<”或“=”);
④图I中M 点对应的溶液中,各离子的浓度由大到小的顺序是______________。
(2)某同学为了研究难溶电解质的溶解平衡,设计了如下实验(相关数据测定温度及实验环境均为25 ℃ ):
操作步骤 | 现象 |
步骤1:向20mL0.05mol/LAgNO3溶液中加入20mL0.05mol/LKSCN溶液,充分反应后过滤 | 出现白色沉淀 |
步骤2:向滤液中加少量2mol/LFe(NO3)3溶液 | 溶液变红色 |
步骤3:向步骤2所得溶液中,加入少量3mol/LAgNO3溶液 | 现象a |
步骤4:取步骤1所得少量滤渣加入到适量的3mol/LKI溶液中 | 出现黄色沉淀 |
查阅资料:AgSCN是白色沉淀:Ksp(AgSCN)=1.0×10-12;Ksp(AgI)=8.5×10-17.
① 请结合化学用语和必要的文字解释步骤2 现象出现的原因:____________________。
②该同学根据步骤3中现象a推知,加入的AgNO3与步骤2所得溶液发生了反应,则现象a为______________(任写一点即可)。
③ 写出步骤4 中沉淀转化反应平衡常数的表达式:K=__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上第二次月考化学试卷(解析版) 题型:选择题
下列变化过程中,需要加入还原剂的是
A.MnO2→MnO4- B.Al(OH)4-→Al(OH)3 C.SO32-→SO42- D.MnO2→MnCl2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中考试化学试卷(解析版) 题型:填空题
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:
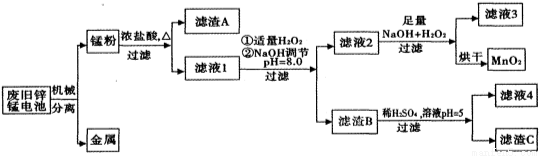
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 / Mn(OH)3 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH(c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是____________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式_________________________。
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式______________________。
(4)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式为______________________。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次月考化学试卷(解析版) 题型:填空题
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子.试回答下列问题:
(1)比较第一电离能:Z_________W(填“>”、“<”或“=”,后同);电负性:X________Y。
(2)写出Q的价电子排布图_____________,YF3的结构式_____________,
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:答:________________________________________。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上期末理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的熵增
B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
C.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl
D.等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上12月模拟化学试卷(解析版) 题型:选择题
氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3?,两步反应的能量变化示意图如下:

下列说法合理的是
A.该反应的催化剂是NO2?
B.升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3?
C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态
D.1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1: 3
查看答案和解析>>
科目:高中化学 来源:2015-2016年陕西西藏民族学院附属中学高二上期末化学卷(解析版) 题型:填空题
有①CH3COOH;②HCl;③H2SO4 三种酸。
(1)CH3COOH溶液中,其电离平衡常数表达式为K = _________________
(2)0.1 mol/L的三种酸溶液,c(H+)由大到小的排列顺序是 (填序号)。
(3)体积相同、c(H+)相同的三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是 (填序号)。
(4)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为___________;
(5)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热量,则醋酸溶液中,醋酸电离的热化学方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com