
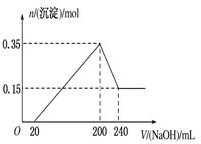
| n |
| V |
| 1 |
| 2 |
| 0.2mol |
| 0.24L-0.2L |
| 1 |
| 2 |
| 0.5mol |
| 0.2L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
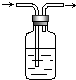 化学实验中的很多气体是用盐酸来制取的,这就导致了这些制取的气体中往往含有HCl杂质,要除去HCl杂质而得到纯净的目标气体,可用图所示装置.如果广口瓶中盛装的是饱和NaOH溶液,则可以用于下列哪种气体的除杂装置是(提示Cl2+H2O=HCl+HClO)( )
化学实验中的很多气体是用盐酸来制取的,这就导致了这些制取的气体中往往含有HCl杂质,要除去HCl杂质而得到纯净的目标气体,可用图所示装置.如果广口瓶中盛装的是饱和NaOH溶液,则可以用于下列哪种气体的除杂装置是(提示Cl2+H2O=HCl+HClO)( )| A、H2 |
| B、Cl2 |
| C、SO2 |
| D、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
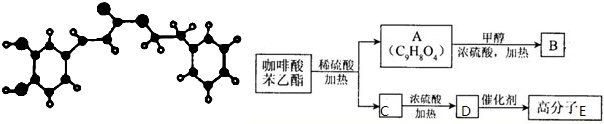
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、HClO、AlCl3 |
| B、NaOH、NH3 |
| C、LiOH、PCl3 |
| D、HCN、BF3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com