
【化学—化学与技术】
I.目前,我国采用“接触法”制硫酸,设备如图所示:
 (1)图中设备A的名称是_____________ ,该设备中主要反应的化学方程式为 。
(1)图中设备A的名称是_____________ ,该设备中主要反应的化学方程式为 。
(2)有关接触法制硫酸的下列说法中,不正确的是_______(填字
母序号)。
A.二氧化硫的接触氧化在接触室中发生
B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2%
D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率
E.硫酸工业中在接触室安装热交换器是为了利用SO3转化为 H2SO4时放出的热量
II. 纯碱是一种重要的化工原料。制碱工业主要有“氨碱法”(索尔维法)和“联合制碱法”(侯氏制碱法)两种工艺。请按要求回答问题:
(3)CO2是制碱工业的重要原料,“联合制碱法”中CO2的来源于 ,“氨碱法”中CO2来源
于 。
(4)氨碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比) 。
(5)写出“联合制碱法”有关反应的化学方程式: 。
科目:高中化学 来源: 题型:
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,Z分别与X,Y形成B、C两种电子数均等于10的分子 且一个B分子中含有的Z原子个数比C分子中少1个 请回答下列问题:
(1)Y元素在周期表中的位置是 周期 族。
(2)B的电子式是 ,B与C反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
ⅰ.高温下用碳还原二氧化硅制得粗硅
ⅱ.粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HCl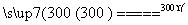 SiHCl3+H2
SiHCl3+H2
ⅲ.SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第ⅰ步制备粗硅的化学反应方程式为___________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点
57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为______________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
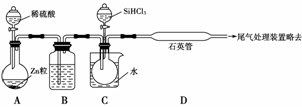
①装置B中的试剂是____________________________________________________。
装置C中的烧瓶需要加热,其目的是__________________________________ _____。
_____。
②反应一段时间后,装置D中观察到的现象是_______________________________,
装置D不能采用普通玻璃管的原因是_______________________________________,
装置D中发生反应的化学方程式为_________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及__________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂是______(填写字母代号)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液
e.Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3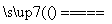 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
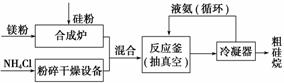
①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是______________________________________
________________________________________________________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式________________________________________________________________________,
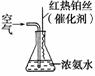 实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
(2 )三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________________________
)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________________________
____________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液
30 mL,则Mg2Si3O8·nH2O中的n值为__________。(注:Mg2Si3O8的摩尔质量为
260 g·mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Mg2+、Al3+等离子。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如下图所示。由此可知原溶液中
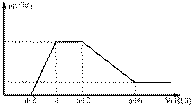 A.不含SO42-
A.不含SO42-
B.含有的阴离子一定是OH-、AlO2-、SiO32-
C.含有的阴离子一定是OH-、CO32-、AlO2-、SiO32-
D.含有AlO2-与SiO32-的物质的量之比为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO 、Fe2+、NH
、Fe2+、NH 、H+和H2O,下列叙述正确的是( )
、H+和H2O,下列叙述正确的是( )
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂物质的量之比为81
C.若有1 mol NO 发生氧化反应,则转移电子5 mol
发生氧化反应,则转移电子5 mol
D.若将该反应设计成原电池,则负极反应为Fe3++e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子反应方程式正确的是( )
A.铜粉与98.3%的硫酸加热下反应:Cu+4H++SO ===Cu2++SO2↑+2H2O
===Cu2++SO2↑+2H2O
B.少量SO2通入苯酚钠溶液中:C6H5O-+SO2+H2O―→C6H5 OH+HSO
C.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O===AlO +2H2O+4NH
+2H2O+4NH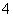
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2===2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立刻产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2气体。
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因:____________________
_____________________ ___________________________________________________。
___________________________________________________。
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份______________________________________________________________。
第二份_______________________________________________________________。
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为(写化学式)________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
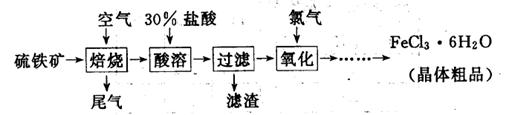
(1)氧化过程中发生反应的离子方程式是 ,检验氧化生成的阳离子的试剂是 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
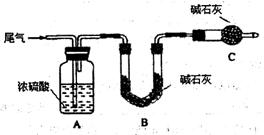
①C仪器的名称是 ,该装置的作用是 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理 ,请说明理由 (若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①加入过量氯化钡溶液的目的是 。
②进行沉淀洗涤的方法是 。
③SO2含量的表达式是 (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3 6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
6H2O晶体的操作包括 、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com